І знову про Капітошок :) Або Нобелівські премії з різницею у 108 років
1 Лютого 2017 | Vasyl
Теги: автофагія, везикули, знай наших!, лізосоми, Нобелівська премія, фагоцитоз

У 1908-му році Нобелівська премія була присуджена Іллі Мечникову та Паулю Ерліху з оригінальним формулюванням «на визнання їх робіт з імунітету». У 2016 році цю визначну наукову відзнаку отримав японський дослідник Йосінорі Осумі за «його відкриття механізмів автофагії». І хоча на перший погляд ці формулювання дуже далекі одне від іншого, між ними досить багато спільного.
Фагоцитоз є окремим випадком ендоцитозу (від грецьких слів «endon» – усередині та «kytos» – клітина) – захоплення клітиною речовин із зовнішнього середовища. При фагоцитозі захоплюються тверді частинки та інші клітини, а при піноцитозі, – речовини, що перебувають у розчині. В обох випадках клітина утворює маленьке вп’ячування своєї мембрани всередину (інвагінація), яке захоплює частину середовища, що оточує клітину. Пізніше краї інвагінації змикаються, і всередині клітини утворюється пухирець (везикула), стінками якого є мембрана клітини, а вмістом – захоплена частина навколишнього середовища.
Фагоцитоз властивий переважно клітинам, що здатні самостійно та активно рухатися (макрофаги та нейтрофіли організмів, у яких є кров, а також вільноживучі найпростіші, тощо). Рух таких клітин найчастіше є амебоподібним, тобто вся організація цитоскелету таких клітин спрямована на постійне та досить швидке утворення вип’ячувань та інвагінацій зовнішньої мембрани. Натомість клітини, що не здатні до активного самостійного руху переважно використовують піноцитоз. Це дріжджі, скажімо, та більшість клітин, з яких складаються багатоклітинні організми. Процеси ендоцитозу в першу чергу використовуються для харчування клітин, але фагоцитоз має також і захисне значення. Більшість білих клітин крові (моноцити, поліморфоядерні лейкоцити), що знайомі кожному, хто здавав аналіз крові, здатні до амебоїдних рухів та фагоцитозу і використовуються організмом для неспецифічного захисту від чужорідних одноклітинних організмів. Саме в цьому і полягає відкриття Іллі Ілліча Мечнікова, який вперше спостерігав явище фагоцитозу на личинках морської зірки в Одесі (на той час там водилися морські зірки!) в експерименті з вельми романтичним дизайном: вводячи в них шипи троянд.
Подальша доля внутрішньоклітинних пухирців, що утворилися в результаті ендоцитозу приблизно однакова. Вони мають злитися з іншими внутрішньоклітинними везикулами, які містять протеолітичні ферменти та деякі інші речовини, що здатні інактивувати та перетравлювати вміст фагоцитарного пухирця. Такі везикули, що містять ферменти для перетравлення різних речовин, переважно білків, містяться у кожній клітині організму та називаються лізосомами (від грецьких слів λύσις (lyses) – розчинення та sōma (soma) – тіло). Як ми вже з’ясували це не лише механізм захисту, а й, у першу чергу, механізм живлення клітин, що спостерігається у організмів протягом всієї еволюції від одноклітинних до ссавців. Тому, так чи інакше, на роботі цієї системи відображаються й процеси голодування.
Однією з універсальних відповідей клітини на голодування є автофагія. Це явище, як видно з його назви, є феноменом самоперетравлення (на відміну від гетерофагії, тобто «пожирання чужорідного», до механізмів якої і належить ендоцитоз). При цьому клітина використовує свої старі, не потрібні в даній ситуації, а також пошкоджені структури, як джерело поживних речовин. Складові цих застарілих та/або недієздатних структур йдуть на побудову нових, більш необхідних, речовин, або виступають джерелом енергії. Якщо клітина використовує свої власні білки, які бере безпосередньо з цитоплазми, то мова йде про мікроавтофагію. При цьому мембрана лізосом вп’ячується всередину, захоплюючи частину цитоплазми, так само, як зовнішня мембрана клітини при ендоцитозі. Якщо ж клітина «вирішила» утилізувати та переробити цілу органелу, скажімо мітохондрію, то говорять про макроавтофагію. При цьому органела оточується спершу окремою мембраною з утворенням автофагічної вакуолі (тобто пухирця, везикули), що потім зливається з лізосомою. Є ще один особливий варіант автофагії: шаперон-залежна. При цьому розщепленню знов таки підлягають цитоплазматичні білки, але їх залучення відбувається за участі інших білків – шаперонів, до яких є відповідні рецептори на поверхні лізосом, що і дозволяє шаперонам доставити в них якийсь цитоплазматичний білок (див. рис.).
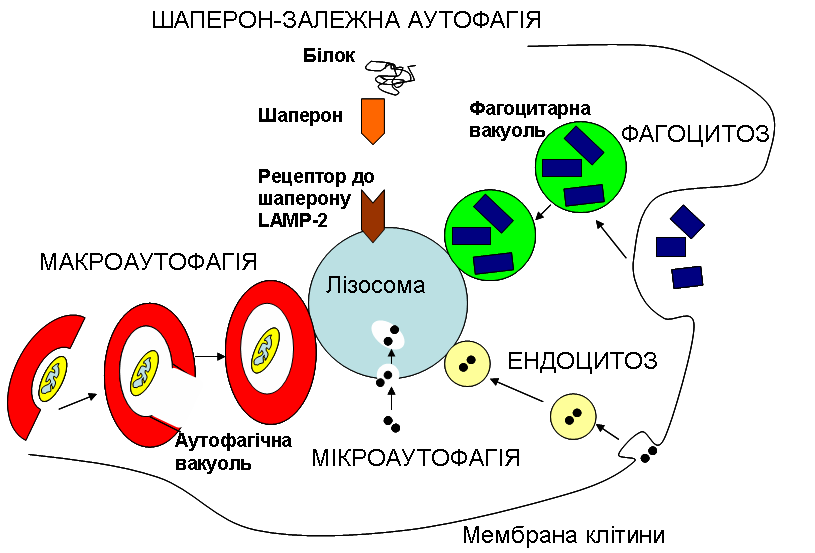
Рисунок виконано на основі схеми, взятої з сайту The Max Delbrück Center for Molecular Medicine. (https://www.mdc-berlin.de/10987285/en/research).
Отже, момент потрапляння субстратів, що знаходяться всередині везикул, у лізосоми, тобто механізм напрямленого транспорту везикул всередині клітини та подальшого злиття лізосом з цими везикулами (фагоцитарними чи автофагічними вакуолями), є спільним для фагоцитозу та автофагії. Цей процес спрямованого руху та подальшого злиття вакуолей регулюється так само, чи дуже близько до того, як відбувається регуляція транспорту пухирців з білками, призначеними для їх вивільнення назовні (екзоцитозу), і відбувається із залученням білків SNARE та SM, про що ми писали окрему цікаву статтю: «Малі капітошки з великими можливостями».
Але що ж особливого в автофагії? За умов шаперон-залежної автофагії жодна везикула не утворюється, а білок шаперон переносить через спеціальні рецептори на поверхні лізосом “неслухняний” білок, що не зміг прийняти правильну конформацію. За умов мікроавтофагії інвагінація утворюється на мембрані самої лізосоми і в самій цій оргнелі створюється маленька додаткова везикула. Але при макроавтофагії в цитоплазмі клітини “з нічого”, так би мовити, формуються нові мембрани, що збираються у велику везикулу. Це відбувається завдяки мембранам комплексу Гольджі, зокрема під час голодування.
Першим на відсутність вільних амінокислот у клітині (що відбувається при голодуванні) у клітинах дріжджів реагує білок mTOR (molecular target of rapamycyn). Він отримав свою назву, бо є мішенню впливу речовини рапаміцин – антибіотика, що був вперше описаний в бактеріях Streptomyces hygroscopicus. Ці бактерії були відкриті на острові Рапа-нуї – оригінальна назва Острову Пасхи (звідки і пішла назва речовини). Білок mTOR активує каскад реакцій, наслідком яких є взаємоактивація дріжджевих білків Atg (скорочення від Autophagy). Результатом активізації цього каскаду є не лише збірка мембран у вакуолю навколо не дуже потрібних ділянок клітини, що стануть джерелом енергії та складових для синтезу нових структур, а ще й підвищена готовність до зупинки в клітинному циклі, апоптотичної клітинної загибелі, тощо. У людських клітинах білки, що відповідають за збірку макроавтофагічних мембран виконують ряд інших функцій і тому рідко називаються просто Atg (наприклад аналог Atg3 є білок Beclin1).
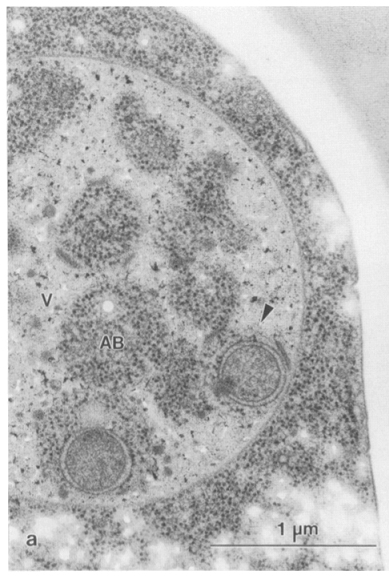
Проте Йосінорі Осумі працював саме на дріжджах за умов їх голодування (див. електронну мікрофотографію) і зробив свої відкриття, почергово вимикаючи то один, то інший білок з Atg каскаду методами напрямленого мутагенезу. Саме ці його роботи якраз і отримали ту найвищу відзнаку, з якої ми розпочали нашу статтю.





Обговорення
23 Лютого 2017, 23:10
Цікава історія! Мабуть встромлю свої 5 копійок, а то останнім часом коментарів під науковими публікаціями небагато 😉
Я навіть і не знав про шаперон-залежну аутофагію, хоча чув про убіквітин-залежну (яка тут, до речі, не згадувалася, видно, пан Осумі нею не займався; на скільки я пам’ятаю, вона стосується передусім мультибілкових сигнальних комплексів, які виконали свою функцію і мають бути перероблені – щоб не розбирати цілий комплекс і не протягувати кожен окремий протеїн через протеасому, везикула поглинає усю ту поліубіквітинільвану громаду заразом; по суті – класична мікроаутофагія).
Ще цікаво, що багато типів агресивних пухлин залежать від аутофагії, оскільки ракові клітини існують в досить несприятливих умовах. А блокування автофагії часто веде до більшої чутливості злоякісних клітин до різноманітних терапевтичних агентів.
Напишіть відгук