Гаряче і холодне торкання від Нобелівського комітету
4 Жовтня 2021 | Олексій
Категорія: Біологія
Теги: іонні канали, електрофізіологія, Нобелівська премія, сенсорне сприйняття, температура тіла
У ці жовтневі дні, коли “Моя наука” традиційно відзначає свою річницю (а цього року 10-річний ювілей, то далі буде!), світ слідкує за Нобелівськими преміями. Сьогодні оголошено премію з фізіології або медицини, а далі будуть інші. Тема виявилася настільки близькою багатьом нашим авторам, що ми перериваємо традицію мовчати в ці хайпові дні й звернемося до нагороджених — іонних каналів, які допомагають нам відчувати температуру та дотик.
Що таке іонні канали?
Без п’яти хвилин нобелівські лауреати Девід Джуліус й Ардем Патапутян присвятили себе дослідженню іонних каналів. Це білкові молекули, які пронизують наскрізь мембрану клітини та здатні робити дуже просту річ — відчиняти пору, яка пов’язує між собою цитоплазму клітини та позаклітинний простір. Оці два простори сильно відрізняються між собою за хімічним складом та електричним зарядом. Цитоплазма клітини повна молекул, які заряджені негативно, особливо залишків органічних кислот: амінокислот, кислих амінокислотних залишків — зокрема глутамату та аспартату — у складі білків, нуклеїнових кислот РНК та ДНК, жирних кислот, фосфорної кислоти тощо. Ми згадали переважно великі молекули, нездатні самостійно перетнути мембрану, а є ще іони хлору, для яких існують канали. З обох боків мембрани також є чимало позитивно заряджених часточок: це переважно іони натрію, калію, кальцію. Іонів натрію та кальцію багато ззовні, а іонів калію — в цитоплазмі. Таку нерівномірність постійно підтримують іонні насоси, які в деяких клітинах споживають чи не третину всієї енергії, що отримує клітина від розщеплення поживних речовин.
Оцю електричну й хімічну несхожість вмісту цитоплазми та міжклітинної рідини — яку дослідники називають електрохімічний градієнт — і використовує клітина, коли треба швидко передати потужний сигнал. Відчинення пори іонного каналу відбувається завдяки спеціальним білковим “воротам”, які зачиняють канал у період спокою. Але як уже відчинилися, то сила електрохімічного градієнту жене іони крізь канальні “дірки” без жодних додаткових зусиль, що викликає струм через мембрану. Швидкості на квантових розмірах такі, що не вкладаються у наші макроскопічні уявлення: у середньому за секунду через калієвий канал проходять 10 мільйонів іонів калію! У порі каналу розташовані структури, що дозволяють пройти тільки певним іонам: або з позитивним, чи з негативним зарядом. Деякі канали настільки перебірливі, що пропускають тільки один тип іонів. Відповідно, існують натрієві, калієві, кальцієві, хлорні канали. Ми писали вже про калієві канали в астроцитах, які допомагають нейронам позбавитися зайвого калію у міжклітинній рідині.
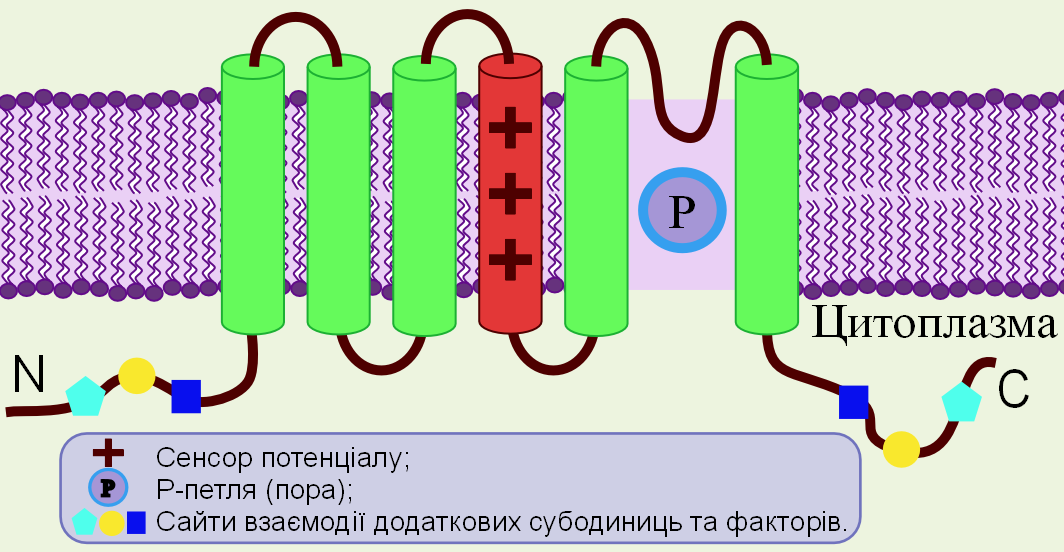
Але найважливішою з точки зору функції клітин та організму є саме воротний механізм каналу, тобто частина білка, яка сприймає зовнішній сигнал. Найбільш відомі канали, залучені в передачі електричного сигналу — потенціалу дії — в нервовій системі. Одні з них мають ворота, керовані потенціалом. Увійшло в клітину трохи позитивних зарядів з іонами натрію чи кальцію — аж ось вони відчинилися. Увійшло дуже багато — і вони зачинилися. Коли хвиля електричного збудження (тобто почергового відчинення багатьох іонних каналів) докотилася до кінця аксона нервової клітини, у щілину між цим та наступним нейроном виділяються маленькі молекули — нейромедіатори. Ацетилхолін, норадреналін, глутамінова кислота, серотонін тощо. Ці молекули подіяли на іншу групу іонних каналів, лігандкерованих, тих, чиї ворота відчиняються при зв’язуванні з малими молекулами, лігандами.
Дві великих надродини іонних каналів з керованими електричним потенціалом і малими молекулами воротами були відкриті давно, у середині XX століття, та добряче вивчені до початку століття нашого. Утім деякі клітини активно реагували появою електричного струму на “нетрадиційні” стимули: зовнішній тиск на клітину, осмотичний тиск зсередини клітини, зміна температури клітини, концентрація іонів водню поблизу мембрани (кислотність, або pH). Що це за білки, які на таке здатні?
Коли послідовність нуклеотидів у геномі людини не була відома, тобто до 2000 року, шукати нові гени й білки було складно. Потрібно було виділяти білок за допомогою методів хроматографії, очищати його та, відрізаючи по одній амінокислоті вивчати його послідовність. За білком можна розшукати й ген, хоча теж непросто, адже генетичний код неоднозначний: одна амінокислота кодується багатьма трійками нуклеотидів. Якщо більшість білків цитоплазми поширені у її тривимірному просторі, то іонні канали та інші мембранні білки розташовані лише в площині мембрани, тобто їх завжди небагато. Для деяких іонних каналів були знайдені організми, де в певних місцях (наприклад, електричний орган вугра чи ската) білку багато. Знайшовши гени цих каналів, науковці почали шукати схожі на них послідовності ДНК, щоб знайти споріднені. У другій половині 1990-х років основні групи іонних каналів були знайдені таким способом, але серед них не виявилося ані температурочутливих каналів, ані механорецепторів.

Температурні рецептори
Тоді Девід Джуліус вирішив, що треба перебрати всі гени, які активні в чутливих нейронах, які реагують на гаряче й одночасно на активну речовину червоного перцю, капсаїцин. Неймовірна праця! Тоді ще не було відомо, скільки генів у людини, оцінки коливалися від 25 до 150 тисяч. Зараз ми теж цього точно не знаємо, але діапазон 18-19 тисяч визнається усіма. Але в кожній клітині працюють принаймні декілька тисяч їх, у тому числі в тих нейронах. Тим не менш робота почалася. Кожну матричну РНК, що свідчить про активність конкретного гену, переводили в ДНК та напрацьовували для так званої “генетичної бібліотеки”. Потім цю генетичну конструкцію вводили в клітинну лінію, яка нечутлива до капсаїцину, молекули-імітатора гарячого. Після незчисленних дослідів потрібний ген був знайдений. Він виявився спорідненим з геном дрозофіли, який кодує іонний канал, відповідальний за сприйняття світла. Мутація в цьому гені спричиняла тимчасову сліпоту в мух через те, що потенціал зорового рецептора в мутантів був не довгий, а короткий, “транзієнтний”. Тому ген мухи назвали “ген транзієнтного рецепторного потенціалу”, або ТРП (TRP англійською). Звідти пішла назва всієї родини, а завдяки тому, що капсаїцин — алкалоїд з групи ванілоїдів (vanilloid), рецептор гарячого отримав назву TRPV1 — перший ванілоїдний ТРП. У подальшому для TRPV1 було знайдено чимало молекул-активаторів та фізіологічних функцій, про що ми теж уже писали на порталі “Моя наука”.
Серед ТРП-каналів був виявлений і холодовий рецептор. Точно так же шукали канал, який відгукнеться на ментол: адже всі уявляють, що м’ята та її активна речовина викликають відчуття холоду в роті. Знаючи вже послідовність першого представника родини, дослідники швидко знайшли й інші. Один із них уперше виявили в… простаті. Вставивши цей ген у чергову клітинну лінію, біофізики побачили, що він відчиняється на ментол. І дійсно, це був новий канал ТРП, якому раніше присвоїли індекс M8, “меластатиновий восьмий”, адже близький до нього ген був виявлений при порівнянні звичайних родимок і клітин злоякісної пухлини меланоми. Цей канал не тільки залучений до формування відчуття холоду, але й наявний у багатьох ракових клітинах, зокрема й у тій самій простаті, де функції його до кінця незрозумілі й досі. Цікаво, що публікації про його клонування й опис з’явилися в журналах Nature і Cell від груп Джуліуса та Ардема Патапутяна майже одночасно в березні 2002 року.
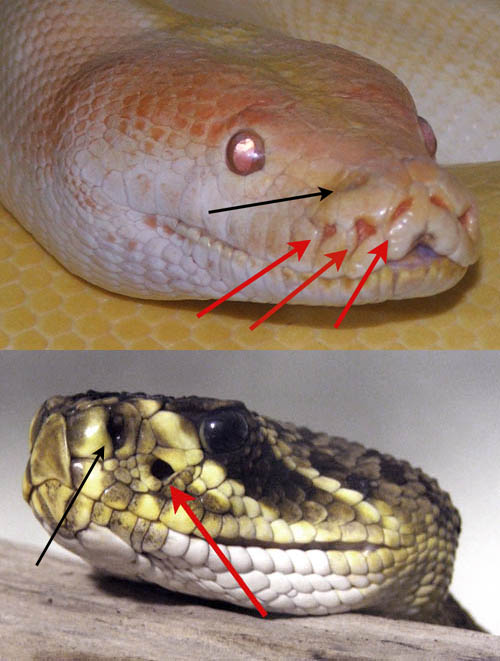
Виявлення температурної чутливості воріт іонних каналів родини ТРП дозволило вирішити чимало біологічних загадок, які мучили зоологів десятиліттями. Так група Джуліуса дослідила механізм інфрачервоного бачення так званих ямкоголових змій, здатних відчути присутність теплокровної миші навіть у повній темряві. Було відомо, що чутливий орган розташований у спеціальній ямці поблизу ніздрів змії, але там знайшли лише нервові закінчення. Молекулярний аналіз показав, що інфрачервоне випромінення вловлює ще один споріднений канал — TRPA1. А ось у кровосисних кажанів з Південної Америки подібну функцію виконує той самий TRPV1, лише з укороченою частиною білка.
Механічне відчуття
Механорецептори також довго шукали серед ТРП-каналів, але так і не могли знайти. Ситуацію ускладнювало те, що іонний канал з воротами, які відчиняються на доторкання, був відомий у бактерій. Проте в ссавців нічого подібного знайти не вдавалося. У середині 2000-х років склалося враження, що всі канали вже відкриті, а ті функції, для яких не вдалося знайти конкретного білка, виконуються групою каналів або спеціально модифікованим уже відомим білком.
Група Ардема Патапутяна блискуче спростувала цю ідею. Перебравши деяку кількість клітинних ліній, дослідники зупинилися на лінії нейробластоми миші, клітини якої регулярно відповідали на натискання тонкою голкою суттєвими струмами. У ній вони виявили 72 рецептори, “вимикаючи” кожен з яких вони зупинилися на тому, за відсутності якого не йшов струм у відповідь на доторк. Канал назвали “п’єзо”, від грецького слова, що означає “тиск”. Перший представник отримав назву “Piezo1”, а вже за аналізом схожих генетичних послідовностей був знайдений Piezo2. Оцей самий Piezo2 виявився головним механізмом, завдяки якому наші чутливі нервові закінчення сприймають доторкання до шкіри.
Нобелівська премія: дають одиницям, а працюють цілі команди науковців
Вітаючи переможців, не варто забувати, що Нобелівська премія давно припинила бути суто науковою чи навколонауковою подію. Сьогодні це шоу на рівні спортивних змагань, де роблять ставки на переможця, відбуваються скандали та інтриги, а церемонія оголошення лауреат-ів/ок та церемонія нагородження складають двомісячну виставу, де всі ролі акуратно розписані. Цим сучасна Нобелівська премія суттєво відрізняється від інших нагород у галузі науки, які присуджуються в колі дослідників або вручаються десь у хвості лауреатів з політики, військової справи, спорту та культури. І саме це є причиною того, що багато науковців критикують самий інститут Нобелівських премій за перенесення уваги від самої сутності наукової праці — важкої, інтелектуальної, колективної.
Коли Нобель складав свій заповіт наприкінці XIX століття, наукою цілком могли займатися одинаки. У тій же фізіології це означало, що дослідник міг сам зібрати прилад з підручних матеріалів, купити собі мікроскоп, завести лабораторних тварин і почати їх оперувати. Якщо на кафедрі не було інших спеціалістів, професор міг бути сам собі лабораторія: читати лекції, проводити лабораторні роботи, ставити експерименти та навчати собі помічників зі здібних студентів. Як ось Никанор Хржонщевський.
Тепер усе не так. Над кожною науковою проблемою працюють сотні науковців, об’єднані в групи по кількадесят, які спираються на досвід тих, хто маленькими кроками просував наше розуміння цієї проблеми десять, двадцять чи тридцять років тому. Сер Айзек Нютон скромничав, коли казав, що “бачив далі за інших тому, що стояв на плечах гігантів”, але в наш час науковий процес відбувається саме так. Тому за іменами Девіда Джуліуса та Ардема Патапутяна, безумовно видатних дослідників, стоять як ті їхні співробітники, що робили тисячі експериментів, вдалих і не вдалих, так і сотні інших вчених, які створили підґрунтя для їхніх проривів. Це і анатоми та морфологи, які описували структури рецепторів та шляхів передачі сигналу до мозку; і біофізики, які розробили методи вимірювання струмів, зокрема петч-клемп; і зоологи, які вивчали поведінку змій і кажанів; і молекулярні біологи, які створили методи збирання генетичних бібліотек — і багато-багато інших.
Тому хочеться, щоб наукова праця отримувала визнання на всіх рівнях, а образ “одинака-генія, який сам-один зібрав установку в гаражі” залишився лише в історії. Вітаючи Нобелівських лауреатів, розуміймо й пам’ятаймо саму сутність наукового методу та наукового дослідження. Щоб дійсно кожен і кожна могли сказати — це моя наука.
Література
- Press release: The Nobel Prize in Physiology or Medicine 2021
-
Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature 1997:389:816-824.
-
TCaterina MJ, Leffler A, Malmberg AB, Martin WJ, Trafton J, Petersen-Zeitz KR, Koltzenburg M, Basbaum AI, Julius D. Impaired nociception and pain sensation in mice lacking the capsaicin receptor. Science 2000:288:306-313
-
McKemy DD, Neuhausser WM, Julius D. Identification of a cold receptor reveals a general role for TRP channels in thermosensation. Nature 2002:416:52-58
-
Peier AM, Moqrich A, Hergarden AC, Reeve AJ, Andersson DA, Story GM, Earley TJ, Dragoni I, McIntyre P, Bevan S, Patapoutian A. A TRP channel that senses cold stimuli and menthol. Cell 2002:108:705-715
- . Nature. 464 (7291): 1006–11. :
- Gracheva, Elena O.; Codero-Morales, Julio F.; González-Carcaía, José A.; Ingolia, Nicholas T.; Manno, Carlo; Aranguren, Carla I.; Weissman, Jonathan S.; Julius, David (2011). Ganglion-specific splicing of TRPV1 underlies infrared sensation in vampire bats. Nature. 476 (7358): 88–91.doi:10.1038/nature10245
-
Coste B, Mathur J, Schmidt M, Earley TJ, Ranade S, Petrus MJ, Dubin AE, Patapoutian A. Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels. Science 2010:330: 55-60
-
Ranade SS, Woo SH, Dubin AE, Moshourab RA, Wetzel C, Petrus M, Mathur J, Bégay V, Coste B, Mainquist J, Wilson AJ, Francisco AG, Reddy K, Qiu Z, Wood JN, Lewin GR, Patapoutian A. Piezo2 is the major transducer of mechanical forces for touch sensation in mice. Nature 2014:516:121-125
-
Woo S-H, Lukacs V, de Nooij JC, Zaytseva D, Criddle CR, Francisco A, Jessell TM, Wilkinson KA, Patapoutian A
Заголовне зображення: автор Richard Robinson, ліцензія CC BY 2.5, через Вікісховище; зі статті Robinson R (2012) Hear Less, Feel Less: One Mutation Causes Loss of Two Senses. PLoS Biol 10(5): e1001322. doi:10.1371/journal.pbio.1001322





Обговорення