Малі Капітошки з великими можливостями
12 Грудня 2013 | Vasyl
Категорія: Біологія
Теги: везикули, Нобелівська премія, ретикулум, транспорт нейромедіаторів
У великих супермаркетах біля кожного касира є така пневматична пошта, яка миттєво передає гроші або рахунки до бухгалтерії. Або у ресторанах трапляються спеціальні прилади від тієї ж пневмопошти до звичайної локальної мережі, що передають замовлення клієнтів на кухню. Я собі мріяв мати щось подібне вдома, щоб, не відриваючись від комп’ютерної гри, замовляти чай з бутербродами собі в кімнату від мами.
Приблизно такі самі потреби виникають і всередині клітини, а також усередині тканин. Клітини потребують постійно спілкуватися одна з одною, і бути в курсі подій, які відбуваються у сусідів.
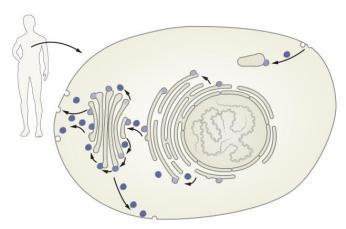
Взагалі передача інформації від клітини до клітини, від тканини до тканини, від особини до особини – є однією з головних передумов еволюції і становлення життя. Багатьом відомо, що передачу інформації між клітинами та тканинами забезпечують хімічні речовини, що їх називають медіаторами. В широкому розумінні слова до цих речовин можна віднести навіть гормони. Всі медіатори виробляються і в подальшому виділяються назовні тими чи іншими клітинами. Далеко не всі медіатори є білкової природи, але все одно вони транспортуються за допомогою системи пухирців. Синтез медіаторів тим чи іншим чином «зав’язаний» на мембранах внутрішньоклітинного апарату – ендоплазматичного ретикулуму (тобто сітки, мережі), що являє собою велику розгалужену мережу канальців та кишень, оточених одношаровою мембраною і найчастіше пов’язаних з ядром. І от, коли якась речовина синтезувалася і потрапила всередину таких канальців, від них відбруньковується маленький пухирець, що містить цю речовину і транспортується до «сортувального пункту», функції якого всередині клітин виконує комплекс Гольджі (за ім’ям італійського вченого Камілло Гольджі, Нобелівського лауреата 1906 року).
Ця структура може повернути речовину назад до ретикулуму, може надіслати її до поверхні клітини з метою подальшого вивільнення речовини у позаклітинний простір, може направити її до інших внутрішньоклітинних структур і т.д.
І весь цей транспорт забезпечується так само мембранними пухирцями, що несуть всередині конкретні речовини. Чим більш складна організація клітини, тим важче доставити необхідні речовини за адресою без помилки. Саме тому ці маленькі пухирці, або мембранні везикули і є надзвичайно важливими компонентами складної регуляції функцій організму. Без них неможливі передача нервових та гуморальних сигналів, обмін речовин, вища нервова діяльність, тощо. Наприклад, один білок має бути модифікований, інший доставлений до поверхні клітини і вбудований в мембрану (рецептори), третій має секретуватися у міжклітинний простір, а четвертий мусить виконувати свої функції всередині клітини. Як розпізнати їх, розподілити по окремих везикулах та направити їх в належне місце?!
Вперше складну внутрішньоклітинну організацію еукаріотичних клітин було описано Альбером Клодом, Джорджем Палладе і Кристіаном де Дювом, які отримали Нобелівську премію в галузі медицини в 1974 році. Завдячуючи їх працям, клітину можна порівняти з великою фабрикою, де в кожному окремому цеху – компартменті – виконується конкретна специфічна робота, а мембранні пухирці – везикули – забезпечують такі окремі цехи необхідним матеріалом та інформацією про потреби. Виявилося, що секреторні білки продукуються в рибосомах на ендоплазматичному ретикулумі, потім транспортуються в апарат Гольджі. Але величезною проблемою лишалося те, як саме конкретний пухирець з білком знаходить своє місце призначення і яким чином білок вивільняється зі свого пухирця. Нобелівську премію у 1999 році було присуджено Гюнтеру Блобелю за відкриття того, що білки мають внутрішні вбудовані сигнали, закодовані у послідовності амінокислотних залишків, що направляють їх транспорт. Це дозволило зрозуміти, чому конкретна речовина направляється за конкретною адресою, а не в якесь інше місце. Але все ж таки, яким чином такі молекули, як, наприклад, гормони чи нейротрансмітери направляються за призначенням, знаходячись всередині везикули, і як саме вони вивільняються назовні?
Не кожна медична чи фізіологічна проблема може похизувати тим, що за її дослідження було призначено декілька Нобелівських премій та ще й протягом такого довгого періоду часу. Хіба що дослідження пухлин. І от, 2013 року вже четверта (сподіваюсь, ви рахуєте по ходу статті?) Нобелівська премія в галузі фізіології та медицини, призначена саме за дослідження везикулярного транспорту.
Доктор Ренді Шекман використовував генетичні методи дослідження на дріжджах для того, щоб ідентифікувати гени, необхідні для везикулярного транспорту. Він довів, що такі гени є необхідними для виживання і можуть бути розподілені на три категорії, що регулюють різні аспекти везикулярного транспорту. Саме з цих генів зчитуються усі білки необхідні для транспорту везикул та їх подальшого злиття з мембраною клітини. Самі білки були визначені раніше Джеймс Ротман з колегами за допомогою використання біохімічних методів. Томас Зюдгоф був зацікавлений, як саме ця система контролюється. Він описав механізм, завдяки якому іони кальцію запускають вивільнення нейромедіаторів і визначив ключові регуляторні та кальцій-зв’язувальні ділянки (домени) в білках, відповідальних за везикулярний транспорт.
То ж зараз картина виглядає приблизно наступним чином. Білки задіяні в процесі злиття везикул з мембранами можна розподілити на три групи: SNARE, SMта білки-шаперони, що допомагають тримати комплекси попередніх двох груп білків разом. Білки групи SNARE (рецептор до розчинного білку SNAР (soluble N-ethylmaleimide sensitive factor attachment protein)) знаходяться на поверхні мембрани везикул. В той самий час на внутрішній поверхні мембрани клітини знаходяться білки комплексу SM (від Sec1/Munc18-like – білок, здатний зв’язувати кальцій на поверхні мембрани). SM-білки зв’язують білки SNARE та змінюють їх так, що фіксують їх на мембрані і щільно притискують мембрану везикули до клітинної. Після цього цей комплекс додатково фіксується за допомогою шаперонів, що одночасно здатні активувати кальцій-залежні механізми злиття мембран і формування пори, через яку і вивільняється вміст везикули. Після злиття та вивільнення вмісту везикули відбувається АТФ-залежний процес роз’єднання SNARE, SM та шаперонів і везикули повертаються знову до ендоплазматичного ретикулуму.
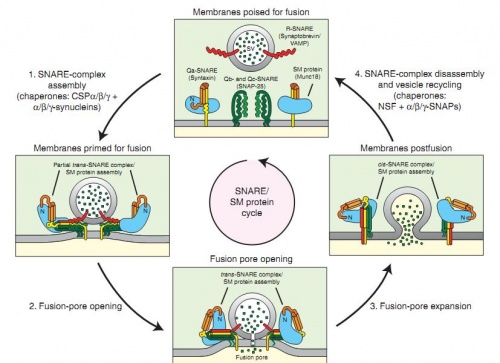
Така складна регуляція цього процесу може здаватися недосконалою, а саме наукове відкриття – не дуже корисним. Але таке відкриття дає можливість робити терапевтичний вплив на велику кількість ланок патогенезу різних захворювань; деякі з цих білків є специфічними для певного типу тканин і навіть пухлин. Тож таке широке поле для подальшого вивчення надає великі перспективи і для лікування багатьох хвороб.
Synaptic Vesicle Exocytosis
Thomas C. Südhof and Josep Rizo
Machinery Regulating Vesicle Traffic, A Major Transport System in our Cells
Juleen R. Zierath and Urban Lendah





Обговорення