Україна — ядерна держава! Про успіхи українських ембріологів у ядерних трансферах
24 Січня 2021 | Olga Maliuta
Категорії: Історія, Біологія, Медицина, Наука та ЗМІ
Теги: ДНК, ембріологія, ембріон, зигота, знай наших!, мітохондрія, мейоз, наука в Україні, ооцит, пронуклеус, штучне запліднення, яйцеклітина
Серед біологів є поширений жарт — ми на День матері малюємо вітальні листівки з мітохондріями. І підписуємо їх: “Дякую тобі мамо за те, чого батько нам дати не зміг”.
Зі школи ми пам’ятаємо, що мітохондрії — то енергетичні станції клітини. І я́к би нас не нудило від цієї фрази, але так воно і є. Проте ці органели то і набагато більше! Вони нащадки давніх бактерій, які уклали симбіотичну угоду з давніми ядерними клітинами. Через це вони зберегли свою власну молекулу ДНК. Вона маленька, кільцева і містить всього 37 генів. Звісно така органела не може вижити всього на 37 генах та продуктах з цих генів (білках чи РНК), тому вона існує на дотаціях і гуманітарній допомозі від ядерної ДНК.
Проблеми мітохондрій
Усі мітохондрії наших клітин є нащадками тих мітохондрій, які нам дістались у спадок від яйцеклітини. Зріла яйцеклітина містить приблизно 200 тисяч копій мітохондріальної ДНК, плюс-мінус десятки тисяч копій залежно від віку та індивідуальних особливостей (мітохондрії окремо як органели важко рахувати, тому рахують кількість копій мітохондріальної ДНК). Саме вони забезпечують енергією ембріон перші дні його існування. Уже після 5 доби розвитку ембріона мітохондрії починають і самі розмножуватись і збільшувати свою кількість у новому організмі.
Звісно, якщо ми десь маємо інформацію, записану в вигляді молекули ДНК, то там можлива з часом поява помилок і мутацій. І в цих нещасних 37 генах детектують до 300 мутацій, пов’язаних з кодуванням рибосомних і транспортних РНК, і ще стільки ж точкових мутацій в кодуючих білкових послідовностях мітохондріальної ДНК. Не знаю, чому мовчить ДНК-мовний патруль тут, але мітохондріальну ДНК навіть вважають найбільш консервативною ДНК наших клітин. Кожна літера тут настільки сповнена змістом, кожен ген такий важливий, що такі мутації в популяціях — украй рідкісна подія. Якщо проаналізувати ці мутації на Землі, то можна прослідкувати історію людства до такої собі гіпотетичної “мітохондріальної Єви”. Уявної жінки, яка жила приблизно 150 тис років тому і стала матір’ю для всього людства, і всі наші мітохондрії є нащадками її мітохондрій.
Мутації інколи викликають хвороби, коли мітохондрії погано функціонують, а особливо якщо збій їх роботи фіксують в органах, які потребують багато енергії. Лише 20% порушень в дихальному ланцюзі мітохондрій, головному конвеєрі цієї фабрики енергії в клітині, пов’язують з мутаціями саме в мітохондріальній ДНК. Інші порушення викликані уже мутаціями в ядерній ДНК, на основі якої продукуються інші необхідні для мітохондрій білки.
Сьогодні лікування хвороб, асоційованих з мітохондріальною ДНК, просто не існує. Часто ці хвороби пов’язані з важкими порушеннями метаболізму. Крім того, утрудненою є діагностика таких хвороб і відслідковування цих порушень в сімейній історії. Найбільшою проблемою є гетероплазмія: явище, коли в кожній клітині та кожному органі дорослої людини можуть бути присутні декілька груп мітохондрій — з мутованою і з різними варіантами нормальної ДНК, а отже може бути різне мутаційне навантаження. Щоб легше уявити це, припустимо, що в кожній клітині є лише по 100 копій мітохондріальної ДНК, і 20% з них мають мутації. Якщо клітина поділилась навпіл, і в одну клітину потрапили всі 20% мутованих копій, то їхній відсоток в клітині збільшиться, до наступного поділу клітина прийде уже з 40% а то і 50% нездорових мітохондрій. Крім того, певні популяції мітохондрій можуть з часом витісняти інші, просто завдяки здатності швидше збільшувати свою кількість під час росту клітини. Також можлива ситуація, коли певні популяції мітохондрій краще “вживаються” з певними ядерними геномами, а з іншими гірше.
Як замінити мітохондрії
Саме через те, що всі мітохондрії в наших організмах є нащадками мітохондрій яйцеклітин, постало питання: а можемо ми хоч додати в їхню цитоплазму трохи мітохондрій без мутацій? А можливо, ми можемо взагалі замінити цитоплазму в яйцеклітині на донорську, що не міститиме пошкоджених мітохондрій? У пошуках відповіді на ці питання почалась ера мітохондріальних трансплантацій у межах технологій штучного запліднення.
Такий трансфер мітохондрій можливий різними способами. Наприклад, можна в цитоплазму клітини, в якій мітохондрії пошкоджені, ввести цитоплазму з клітини донора з нормальними мітохондріями. Найпростіша методика донації цитоплазми.
Запліднення яйцеклітин відбувається ще до завершення поділу мейозу, тому в яйцеклітини можна забрати веретено поділу з усіма хромосомами і пересадити його в цитоплазму донорської клітини, з якої попередньо видалили таке ж веретено. Це називається трансфером веретена поділу.
Можна отримати у жінки незрілі яйцеклітини, у яких збережене ядро (такі клітини називаються гермінальними везикулами), і відповідно застосувати методику ядерного перенесення на стадії гермінальних везикул. Потім такі клітини проходять дозрівання в умовах in vitro. Ця технологія поки найскладніша для ефективного відтворення та застосовується лише з модифікаціями і надзвичайно рідко.
Можна взяти генетичний матеріал з полярних тілець, що утворюються після першого та другого поділу мейозу, і пересадити їх у позбавлену ядерної ДНК цитоплазму донорських клітин. В Україні народилась перша дитина в світі після перенесення генетичного матеріалу з першого полярного тільця в цитоплазму яйцеклітини донора. Цього успіху досягли в клініці ІГР (Інститут генетики репродукції) і повідомили про це спільноту на конференції Української асоціації репродуктивної медицини в 2019 році.
Після таких маніпуляцій проводять звичне запліднення клітин і культивують ембріони.
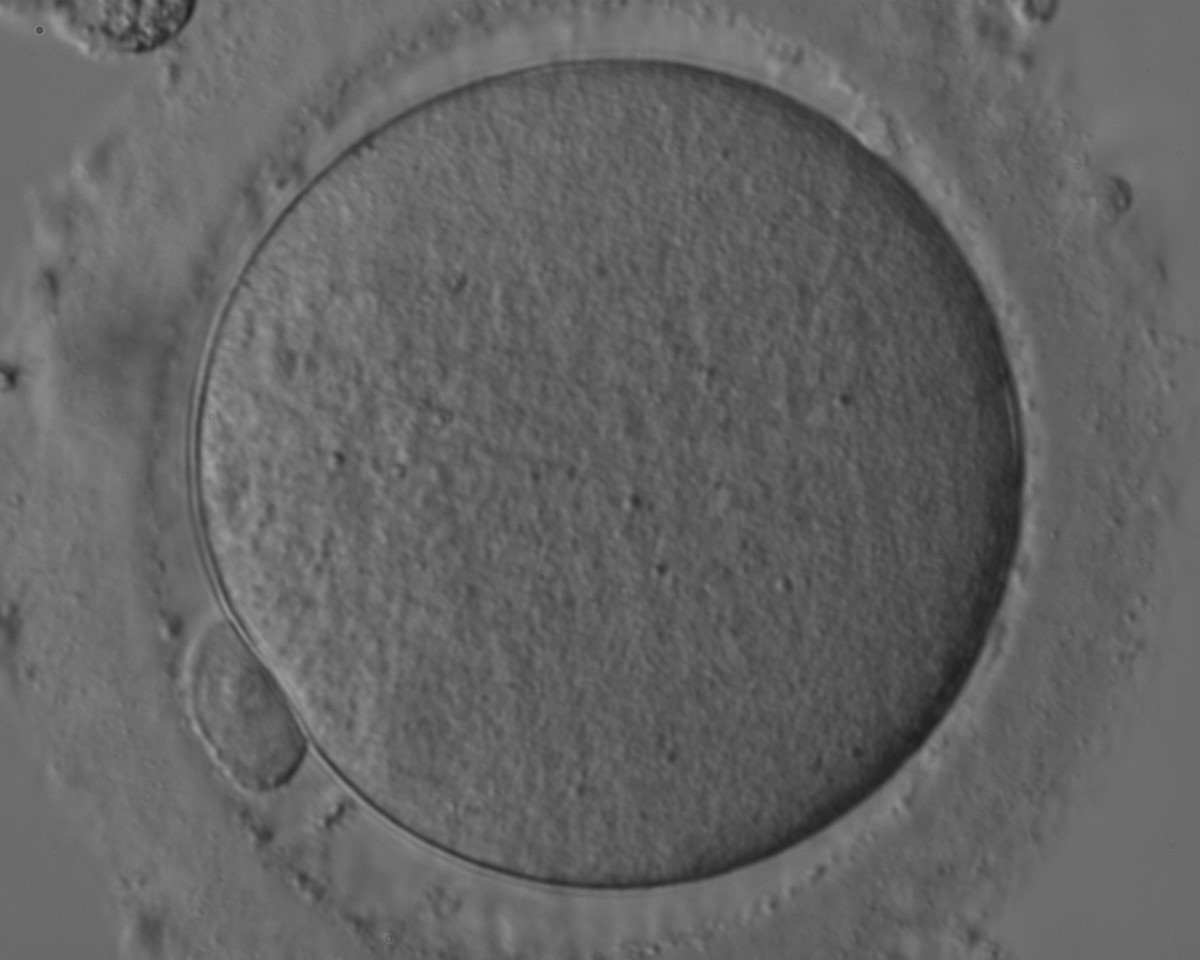
Якщо говорити про технології, які можна застосовувати після запліднення, то це, перш за все, перенесення пронуклеусів. Після запліднення утворюється зигота — ембріон на стадії однієї клітини. В зиготі десь після 7-8 годин після проникнення сперматозоїда починають візуалізуватись 2 пронуклеуса — “проядра”. В одному міститься 23 хромосоми від матері, в іншому 23 хромосоми від батька, після їх злиття ембріон починає відразу дробитись. Розділяється на перші дві клітини він, приблизно починаючи з 24-26 годин після запліднення. Є короткий проміжок часу від 12-14 годин до 18-20 годин по заплідненню, коли ці пронуклеуси чітко видно в клітині. Їх можна видалити з потрібної зиготи і помістити в донорську зиготу, що була утворена заплідненням донорської яйцеклітини спермою чоловіка.
Ще одним варіантом є трансфер ядра з клітин ембріона на ранніх стадіях розвитку (2-3 день після запліднення) в позбавлену ядерної ДНК цитоплазму зиготи чи яйцеклітини.
А що в Україні?
В Україні всіма варіантами таких маніпуляцій займається ембріолог Павло Мазур. Завдяки його зусиллям в нашій країні народилась перша в світі дитина саме після процедури пронуклеарного перенесення. В ембріології успішність певної методики стверджується лише після народження здорової дитини. Так, для технології пронуклеарного трансферу відправною точкою стало 5 січня 2017 року. Здоровій дівчинці на момент цієї публікації виповнилось уже 4 роки!
Цікаво, що Павло вирішував за допомогою цієї методики зовсім іншу проблему, можливою причиною якої є саме наявність мутацій у мітохондріях (але це не точно). Є невелика частка пацієнтів, які проходять лікування безпліддя методами штучного запліднення, і в яких практично неможливо отримати здоровий ембріон на 5-ту добу розвитку — бластоцисту. Всі їхні ембріони в кожному новому циклі стимуляції зупиняються у розвитку на 3-тю добу від запліднення, або раніше. У керівника клініки Валерія Зукіна, де працює Павло, виникла ідея: а що як причина криється не в ядерній ДНК ембріона, а в якихось цитоплазматичних факторах? Тоді, можливо, заміна цитоплазми допоможе таким пацієнтам отримати нормальні бластоцисти й народити генетично власну дитину.
Починав Павло роботу над технологіями заміни цитоплазми ще в 2014 році. І спочатку намагався то робити з ядрами гермінальних везикул — незрілих яйцеклітин. А пізніше, у 2015 році, Павло починає експериментувати з аномальними зиготами. Інколи яйцеклітина після запліднення неправильно проходить фінальний етап дозрівання і не викидає в полярне тільце зайві 23 хромосоми. У підсумку утворюється третій пронуклеус у зиготі. Такі ембріони не підлягають подальшому використанню, адже з них виростають генетично аномальні ембріони. Павло відпрацював методику виділення пронуклеусів, їх перенесення в цитоплазму донорської зиготи, з якої попередньо видалили генетичний матеріал. І виявилось, що в результаті таких маніпуляцій ембріони виживають і навіть доростають до стадії бластоцист!
Залишилось лише одне — за чіткими критеріями відбору знайти пацієнтів, для яких ця методика дійсно може допомогти подолати зупинку розвитку ембріонів. А потім найважче: ще треба пояснити цю ідею пацієнтам з надією, що хтось погодиться на абсолютно експериментальну і, можливо, занадто сміливу процедуру. З грудня 2015 року починається безпосередня робота з яйцеклітинами пацієнтів, що у декількох циклах лікування безпліддя мали повну зупинку розвитку ембріонів.
Для Павла ключовим було паралельно проводити і зворотній трансфер, коли пронуклеуси донорської зиготи переносили в цитоплазму пацієнтів. З однієї сторони це більш етично, адже жоден донорський ембріон при цьому не утилізували, і навіть більше — якщо він доростав до бластоцисти, то його заморожували і зберігали. Бо окрім того, що в результаті такого пронуклеарного трансферу дійсно вдавалось отримувати хороші морфологічно та хромосомно бластоцисти з генетичним матеріалом пацієнтів у донорській цитоплазмі, так, на диво, зиготи з генетичним матеріалом донора і цитоплазмою пацієнтів теж інколи спокійно доростали до бластоцист. Найкращі результати саме в зворотніх трансферах спостерігали в жінок старшого репродуктивного віку, це чітко показувало, що з їх цитоплазмою все добре. Причиною зупинок в розвитку ембріонів у старшому віці є все ж порушення в генетичному матеріалі ядра, а не в цитоплазмі.
Генетичні історії варіюють
Перша пара, в якої народилась дівчинка після пронуклеарного трансферу, була, насправді, четвертою парою, яка погодилась на таку експериментальну процедуру. Сьогодні в списку дітей після пронуклеарного трансферу, здійсненого Павлом, уже 10 записів. Цей список, який він презентує на конференціях, він підписує цитатою “our preciousss”. 10-та дитина в цьому списку є хлопчиком і братом першої дівчинки. Пара повернулась в клініку за другою дитиною. А Павло не приховує свого захоплення від сміливості і сили цієї жінки, яка пройшла через безліч невдалих спроб, яка 15 років боролась з проблемою безпліддя, зважилась на абсолютно експериментальну процедуру, виносила і народила двох малюків.
Враховуючи, що з заміною цитоплазми замінюються і мітохондрії, то в лабораторії перевіряли і співвідношення гаплотипів мітохондрій від пацієнтів і донорів цитоплазми. Завжди важливим є питання про те, яка частка мітохондрій потрапляє в майбутній організм після пронуклеарного трансферу. Цікаво, який рівень гетероплазмії буде в результаті таких маніпуляцій, а отже чи можна буде таку методику використовувати для попередження передачі хвороб, асоційованих із мутаціями у мітохондріальній ДНК. Показовим є саме випадок першої народженої дівчинки і її брата. Адже маніпуляція була виконана однією людиною, в тих самих умовах, з клітинами одного донора. У дівчинки рівень гетероплазмії мінімальний і в клітинах її тіла наявно менше одного відсотка материнських мітохондрій, майже всі мітохондрії вона успадкувала від донора. У той же час у хлопчика в клітинах тіла знайдено 72% материнських, не донорських, мітохондрій! Важко пояснити таку разючу різницю в розподілі мітохондрій і спрогнозувати, чи з часом одна популяція мітохондрій не витіснить іншу повністю. Скоріше це абсолютно випадкові флуктуації. Якщо уявити такий високий рівень гетероплазмії при роботі з мутованою мітохондріальною ДНК, то така методика уже не здається панацеєю від таких мітохондріальних хвороб.
Але Павло має на думці перевірити в майбутньому деякі свої ідеї, як практично позбуватись саме материнських мітохондрій, після ядерних перенесень, щоб уникати таких флуктуацій.
Можливий варіант, що з часом таки розроблять ефективні методи редагування геному мітохондрій, можливо почнуть застосовувати методики редагування окремих пар нуклеотидів, так званий base editing, редагування нуклеїнових основ у ДНК. При цьому за допомогою ферментів можна хімічно перетворити наприклад цитозин (Ц) на тимін (Т), і в результаті замінити в мітохондріальній ДНК пару Ц-Г на Т-А. Основна перевага цього методу полягає в тому, що ДНК при цьому не розрізається, а це є критичним саме для мітохондріальної ДНК, де погано працюють механізми зшивання розривів. Саме це обмежує використання для мітохондріальної ДНК технології генетичного редагування CRISPR-Cas9.
Методику пронуклеарного перенесення Павло не рекомендує застосовувати для яйцеклітин пацієнток старшого репродуктивного віку, адже з віком збільшується частота хромосомних аномалій і вже основним чинником невдач буде отримання генетично аномальних ембріонів. На жаль, навіть заміна цитоплазми не відрегулює процеси розподілу хромосом.
Завдяки роботі Павла було показано і вплив на розвиток ембріонів певних мутацій в ядерних генах білків субкортикального материнського комплексу. Це унікальний для клітин ссавців білковий комплекс, що працює на ранніх етапах розвитку ембріона і закладається ще на стадії дозрівання яйцеклітин. Якщо в жінки присутні мутації в генах цих білків, то ембріони можуть зупинятись в розвитку через некоректну роботу таких цитоплазматичних факторів.
А ще в списку дітей після пронуклеарного перенесення є й дівчинка, мати якої була носієм мутації в гені бета-тубуліну TUBB8, через яку порушується дозрівання ооцитів та ранній розвиток ембріонів. Завдяки генетичній перевірці ембріонів перед імплантацією вдалось відібрати саме ембріон, який уже не несе цієї мутації.

Павло Мазур завершив бакалаврат зі спеціальності вірусологія і отримав ступінь магістра з генетики в Київському національному університеті імені Тараса Шевченка. Працює клінічним ембріологом в репродуктивній клініці “Надія”. Є сертифікованим старшим ембріологом Європейської асоціації репродуктологів та ембріологів. Завжди може порадити смачне алкогольне або безалкогольне пиво та добре знається на каві. Навіть на міжнародних конференціях примудряється вставити в презентацію слайди з мемами. Ніколи не відмовляється прочитати популярну лекцію на “Днях науки“. Має сильно виражені проукраїнські погляди. “Україна ядерна держава” ще й через успіхи її науковців в ядерних перенесеннях. Павло мріє про те, щоб вона стала і першою термоядерною державою у світі. Він виховує з чудовою дружиною Анною двох синів. Анна теж біолог, і Павло завжди говорить, що без неї вся його робота не мала б успіху. Любить футболки з принтами Гуся і зображеннями Rainbow Dash, але на свої виступи на міжнародних конференціях одягає лише вишиванки. Відвідує і підтримує Pride марші. Є дуже відкритим до співпраці, завжди готовий обговорити ембріологічні питання з колегами ембріологами і допомогти. Його можна побачити в четвертій серії документального серіалу від Netflix “Unnatural selection”.
Завжди жартує, що на фото з дитиною, яку всі ЗМІ охрестили “дитиною від трьох батьків”, дійсно присутні аж три батька: ембріолог, лікар-репродуктолог та директор клініки, в якій то стало можливим. Його згадка саме про той момент на фото:
– Не було якоїсь специфічної радості, що от, це успіх саме пронуклеарного трансферу. Була щира і проста радість ембріолога нарешті побачити результат своєї роботи. Дитину, якій ти хоч трохи допоміг з’явитись на світ. Адже в цьому недолік нашої професії: ми, на відміну від лікарів, рідко бачимо народжених дітей, заради яких ми працюємо.
Література
- A.S.Reznichenko, C. Huyser, M. S. Pepper. Mitochondrial transfer: Implications for assisted reproductive technologies Applied & Translational Genomics. Volume 11, December 2016, Pages 40-47
- Pascale May-Panloup at all. Ovarian ageing: the role of mitochondria in oocytes and follicles. Human Reproduction Update, Volume 22, Issue 6, 20 November 2016, Pages 725–743
- Xueqian Wang et al, Novel mutations in genes encoding subcortical maternal complex proteins may cause human embryonic developmental arrest. Reprod Biomed Online. 2018 Jun;36(6):698-704.
- D. Bebbere. L. Masala, D. F. Albertini,and S. Ledda The subcortical maternal complex: multiple functions for one biological structure? J Assist Reprod Genet. 2016 Nov; 33(11): 1431–1438.
- Beverly Y. Mok at all. A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing. Nature volume 583, pages631–637(2020)
- Матеріали онлайн конференції International IVF Initiative. SESSION 44: REBOOT – CYTOPLASMIC MANIPULATION FOR IVF FAILURE
Ані авторка, ані редакція порталу “Моя наука” не отримали за цю статтю жодних винагород від жодної зі згаданих осіб чи компаній – Редакція.





Обговорення
25 Січня 2021, 11:26
Ахуєнна історія.
Не знав, що він перший у Світі.
Сподіваюся дружина скине Павлу статтю і він почитає, вже готовий варік.
ЗІ: пощастило пацану, його материнські мітохондрії нікому не зашкодять.
25 Січня 2021, 11:51
Павло вичитивав статтю до публікації)
А з переносами там скандали і інтрігі) бо перша дитина, але після трансферу веретена поділу, народилась восени 16 року у Занга. Він то робив в Мексиці, бо в Штатах був бан. І відновив він свою роботу після листа Павла де він запитував якісь деталі. А ще перед цим були вагітності в світі після таких трансферів, але діти не народились, бо чогось в матку підсадили багато ембріонів і багатоплідна вагітність нічим хорошим не закінчилась. Карочє, там можна і серіали знімати на Нетфліксі, не лише документалки
27 Січня 2021, 18:31
А як же????
https://www.pnas.org/content/115/51/13039
27 Січня 2021, 19:51
А Ви читали відповіді на цю статтю? Ми плануємо за деякий час опублікувати цю майже детективну історію на “Моїй науці”.
27 Січня 2021, 21:19
додамо до коментаря @Олексій, так, навіть в самій статті є відповідь у вигляді листа: No further evidence for paternal leakage of mitochondrial DNA in humans
Напишіть відгук