Геномне редагування людських ембріонів: крок уперед
8 Серпня 2017 | Молекулярно про Рак
Теги: CRISPR, генетична інженерія, геномне редагування, ГМО, ембріон, рекомбінація ДНК, спадкові захворювання, штучне запліднення
Американські вчені генетично модифікували людський ембріон за допомогою CRISPR-Cas9! Наближається ера техногенної еволюції людини! Багато хайпу, але що по суті зробили в Орегонському Університеті Здоров’я та медицини (Oregon Health and Science University)?
Вчені працювали над корекцією гену, що викликає гіпертрофічну кардіоміопатію. Це окремий тип генетично-опосередкованих захворювань, які називаються аутосомно-домінантними (викликаються великою літерою “А” в генотипі Аа, тобто всі пацієнти є гетерозиготами, гомозиготи “АА” найчастіше вмирають ще в дитинстві). Такі хвороби як правило проявляються в репродуктивному віці, тому їхня частка в популяції людини досить висока. Відповідно, коли один з батьків страждає на захворювання, ймовірність народження хворої дитини: Аа x аа = 50 % Аа (хвора) на 50 % аа (здорова). Шанси на невдачу достатньо високі, тому батьки змушені звертатися по допомогу до клініки репродуктивної медицини, де виконують запліднення в пробірці і вибирають здорові ембріони з-поміж 50 % “аа”. Стараннями портландських вчених частка здорових “аа” ембріонів в пробірці зросла з природних 50-ти до запаморочливих 74.2 відсотків. АЛЕ! В ході експерименту вони зробили декілька дуже важливих спостережень.
#1. В статевих клітинах (гаметах) та ранньому ембріоні гомологічна рекомбінація значно ефективніша, ніж в “дорослих” (соматичних) клітинах. Це чудова новина, оскільки саме цей тип рекомбінації потрібен для спрямованого виправлення помилок в генах.
CRISPR-Cas9 працює за принципом: не розіб’єш яйця – не посмажиш яєшню. Спочатку Cas9 протеїн знаходить мутацію в клітинній ДНК за допомогою провідникової РНК молекули (sigle guide RNA, sgRNA), яка з’єднується з мутованим сайтом за принципом комплементарності. Потім Cas9 розрізає спіраль ДНК, утворюючи так званий дволанцюговий розрив. Надалі клітина реагує на поламку із залученням ферментів репарації – білків, які збирають ланцюг ДНК докупи. Існує два шляхи, якими клітина це робить. Перший – швидкий та неточний, називається негомологічне з’єднання кінців (Non-homologous end joining, NHEJ). В результаті такого “з’єднання наосліп” сполучений сегмент ДНК має дрібні мутації, які повністю виводять з ладу білок, що кодується цим геном. Ясна річ, що терапевтична цінність цього механізму – нульова. На противагу, другий шлях – гомологічна рекомбінація (Homology directed repair, HDR) – вимагає більше часу, але виправляє дволанцюглвий розрив ідеально без жодних швів. HDR потребує наявності ДНК-шаблону, що містить інформацію, необхідну для такої високоточної роботи. Тому дослідники вводять в клітину спеціальний ДНК фрагмент (штучну матрицю) поряд із Cas9 ензимом та провідниковою РНК, якщо хочуть полагодити певний ген.
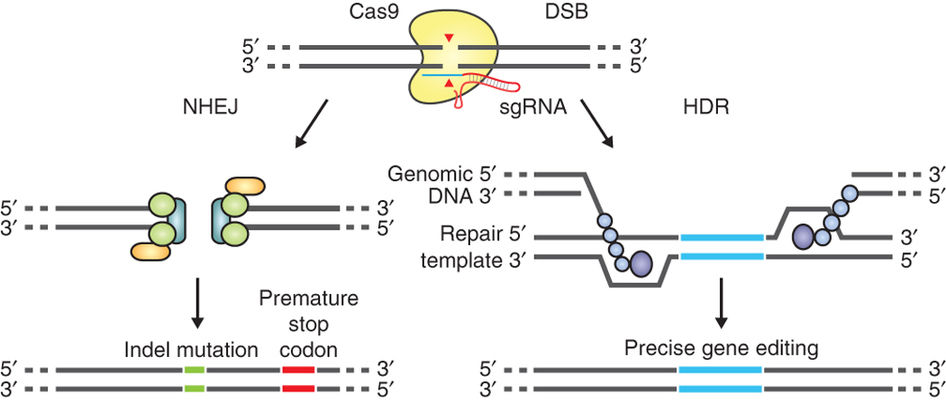
Проблема полягає в тому, що в клітинах здорової дорослої людини ефективність неточного шляху репарації (NHEJ) значно переважає. Але виявляється, що в яйцеклітині повно HDR ензимів, які ретельно пильнують за цілісністю ДНК майбутньої дитинки. Вченим залишається лише навести ці системи на потрібну мутацію за допомогою CRISPR-Cas9, а далі клітина все робить сама в найкращому вигляді. Цікаво, що в більшості виправлених ембріонів мутантний алель “А”, який нес сперматозоїд, був заміщений здоровим алелем “а”, що містився на материнській хромосомі. Тобто яйцеклітини/зиготи часто ігнорували штучну матрицю, введену вченими, і надавали перевагу природному шляху усунення помилок в ДНК.
#2. Вводити Cas9 потрібно разом із сперматозоїдом, коли яйцеклітина знаходиться на стадії метафази другого мейозу. Такий підхід гарантує, що виправлення мутантного алелю відбудеться ще до того, як зигота почне ділитися (увійде в стадію дроблення). Це в свою чергу зводить нанівець можливість виникнення мозаїцизму: ситуації, коли виправлення відбулося лише в частині клітин ембріону, а решта клітин залишилися мутантними. Зрозуміло, що мозаїцизм є абсолютно неприпустимим, якщо ми хоч якось натякаємо на потенційне клінічне застосування технології. Тож, з результатів дослідження постає чітка стратегія уникнення цього неприємного явища. Насправді, мозаїцизм ембріонів становив серйозну заваду для CRISPR-Cas9 на шляху до клініки, і тепер ця перешкода, здається, позаду.

Але незважаючи на такі обнадійливі результати, традиційно залишаються питання, на які треба відповісти, перш ніж ембріональна інженерія стане рутинною медичною процедурою. По-перше, що робити із генетичними захворюваннями, які не є аутосомно-домінантними? Ембріони (і в подальшому люди) із рецесивними хворобами мають генотип “аа”, тобто є гомозиготами. В такої клітини немає здорового алелю “А”, який міг би замістити хворий алель “а”. Укупі із спостереженням, що яйцеклітина неохоче використовує штучну матрицю, це означає, що родини, де обидва батьки страждають на захворювання (геноти “аа”), досі не мають шансів на здорових нащадків. По-друге, що робити із рештою 25.8 % ембріонів, в яких репарація пройшла неточним (NHEJ) шляхом, як звести цей показник до 0 %? Наразі існують експериментальні підходи як блокують NHEJ на час проведення генетичної маніпуляції, але всі вони засновані на застосування хімічних речовин (інгібіторів). Проте травити зародок на ранніх стадіях розвитку хімікатами, мабуть, не найкраща ідея. По-третє, в CRISPR-Cas9 технології є один загальний недолік, який стосується не тільки ембріональної інженерії, – це неспецифічна дія. Насправді, наведення Cas9 ензиму на цільовий ген за допомогою провідникової РНК, що працює на принципі спалювання комплементарних нуклеотидів, є найбільш точним та ефективним методом, але і він інколи “збоїть”. Автори даного дослідження підтвердили відсутність так званих позацільових ефектів (off-target effects) двома незалежними методами в усіх ембріонах із бажаним генотипом “аа”. Але це скоріше можна вважати вдачею, оскільки неспецифічність Cas9 сильно різниться між експериментами і часто-густо її дуже складно, ба, навіть неможливо, передбачити. В цьому напрямі теж інтенсивно ведуться дослідження, тож будемо сподіватися, що з часом технологія дійсно стане достатньо ефективна та безпечна для її застосування в клініці.
Даниїл Грибчук для Моєї Науки
Джерела:
Стаття із оригінальним дослідженням в Nature (ті, хто в темі – не полінуйтеся, прочитайте її повністю, вона у вільному доступі; в мене це зайняло годину часу, ще дві пішло на написання цього тексту ;)))
Ma, H., Marti-Gutierrez, N., Park, S.,W., Wu, J., et. al. (2017). Correction of a pathogenic gene mutation in human embryos. Nature (in press). doi:10.1038/nature23305.
Опис дослідження та інтерв’ю виконавців на Sciencemag
Servick, K. (2017). First U.S.-based group to edit human embryos brings practice closer to clinic. Science. doi:10.1126/science.aan7197.





Обговорення