Де не справляється людська – справиться бактеріальна імунна система: Можливості застосування CRISPR/Cas9 для генної терапії вірусу імунодефіциту людини (кінець)
23 Грудня 2014 | Молекулярно про Рак
Категорія: Медицина
Теги: ex vivo, імунна система, ВІЛ, генна терапія, геномне редагування, снід, стовбурові клітини
Якщо ви раптом потрапили одразу сюди, то має сенс перечитати передісторію…
У світлі таких захопливих наукових результатів, міжнародна дослідницька група (з 12-ти американських та одного шведського інститутів) вирішила піти далі і застосувати іншу ефективнішу систему геномного редагування для видалення CCR5 гену в гемопоетичних стовбурових клітинах людини. Ось тут на передній план виходить анонсована раніше імунна система бактерії. Її застосуванню в якості інструмента генетичних маніпуляцій передував тривалий період (30 років) вивчення її природи. Спершу увагу вчених привернули чудернацькі послідовності в геномі багатьох бактерій – так звані групи коротких паліндромних повторів, перемежованих із унікальними послідовностями (Clustered Regularly Interspaced Short Palindromic Repeats, CRISPR). У ході досліджень з’ясувалося, що вони є нічим іншим, як записаною до бактеріального геному пам’яттю про бактеріофагів, які колись потрапляли в клітину. У разі повторної атаки вірус-специфічні некодуючі РНК (так звані crRNA), що транскрибуються з CRISPR-локусу, допомагають спеціальним ендонуклеазам знаходити на знищувати фагову ДНК шляхом утворення дволанцюгових розривів, реалізуючи таким чином набутий імунітет. Механізм трохи подібний до РНК інтерференції, але той факт, що він спрямований саме проти дволанцюгової ДНК, а не РНК, робить CRISPR систему безцінним інструментом генно-інженерних досліджень, а особливо стала у пригоді науковцям CRISPR/Cas9 Streptococcus pyogenes. Тільки за 2013 рік з’явилося щонайменше з десяток публікації з її використанням у трійці найвпливовіших біологічних журналів (Nature/Cell/Science). Оскільки, немає змоги вставити сюди детальний опис CRISPR/Cas9, запрошую читачів докладніше ознайомитися (рідною мовою!) з історією дослідження, молекулярним механізмом дії та типами маніпуляції із геномом тут.
Отже, судячи зі статті, опублікованій в Cell Stem Cell, вченим вдалося довести, що CRISPR/Cas9 в комбінації із CCR5-специфічними crRNA є ефективною в здійсненні нокауту гену CCR5 в недиференційованих клітинах кровотворення, так званих гемопоетичних стовбурових клітинах (ГСК) людини. Відповідно до схеми експерименту, було виконано нуклеофекцію ГСК двома плазмідами, одна з яких несла послідовність ендонуклеази Cas9 під сильним цитоменаловірусним промотором, а друга – послідовність однієї або двох crRNA (під U6 промотором РНК-полімерази ІІІ), що виконували наведення ендонуклеази на ген CCR5. Важливо відзначити, що такий підхід ґрунтувався на тимчасовій експресії зазначених генетичних конструкцій подібно до ZFN-стратегії, але не передбачав використання вірусів для переносу генів, що значно підвищує безпечність такої процедури у разі її застосування із терапевтичною метою. В ході аналізу даних було встановлено, що найбільша ефективність нокауту спостерігалася у разі одночасного використання двох crRNA, спрямованих проти різних частин гену CCR5, що мало наслідком делецію або інверсію фрагмента, який містився між сайтами розрізання, і в підсумку призводило до нокауту. Принципово важливою знахідкою було те, що після модифікації ГСК зберігали здатність диференціюватися у всі типи клітин крові: in vitro утворювали різні типи колоній на метилцелюлозі, а in vivo спостерігалася успішна репопуляція кісткового мозку та селезінки NOD/SCIDмишей. Разом із тим CCR5–/– фенотип передавався їхнім нащадкам – спеціалізованим клітинам крові. Також глибоке секвенування отриманих клітин виявило низький рівень неспецифічності (або так званих позацільових ефектів – off-targeteffects), але в одному випадку таки було встановлено неспецифіку: під «гарячу руку» Cas9 потрапив ген CCR2, що мав гомологічні ділянки із цільовим геном. Проте, як запевняють вчені, якщо дуже ретельно підходити до дизайну crRNA, такі випадки можна легко попередити. Тож, побачимо, чи отримає дане дослідження продовження у вигляді клінічних випробувань. Теоретично, у разі модифікації стовбурових клітин крові нокаутований алель стабільно відтворюється у всіх клітинах крові протягом більш тривалого часу в порівнянні із модифікацією зрілих клітин крові. У попередньому дослідженні із ZFN-стратегією пацієнти спостерігалися лише протягом 300 днів, а що відбувалося із ними потім – історія, як то кажуть, замовчує. Ефективний нокаут в стовбурових клітинах по ідеї дозволить забезпечити пацієнта нечутливою до вірусу СНІДу імунною системою аж до старості. Нижче подано графічний огляд з оригінальної публікації в Cell Stem Cell.
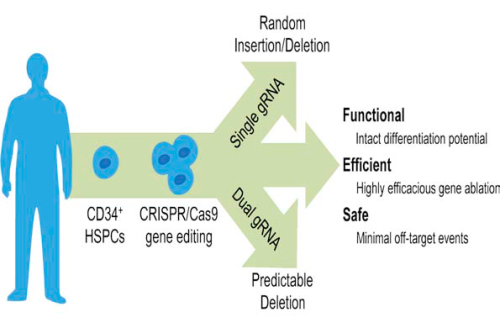
Для того, щоб трохи збалансувати оптимізм – коротко про можливі недоліки та перестороги такого підходу. По-перше, існує певна лабільність env-протеїну вірусу імунодефіциту, тож існує ймовірність, що внаслідок селекції вірус почне використовувати інші схожі хемокінові рецептори для входження в клітину. Зокрема є відомості, що ВІЛ не цурається CXCR4, і хтозна які ще в нього є можливості варіабельності? По-друге, слід поглянути на рисунок, поданий на початку, який зображує шляхи передачі ВІЛ, щоб зрозуміти, що CD4/CCR5 — це основний, проте не єдиний спосіб входження вірусу до імунних клітин. В умовах селективного тиску допоміжні шляхи певно стануть основними. Тож, вірогідно, такий підхід до терапії ВІЛ/СНІДУ не буде панацеєю, а натомість дозволить виявити нові досі невідомі аспекти біології вірусу. По-третє, досі вичерпно не досліджені всі можливі функції рецептору CCR5. Те, що його нокаут суттєво не впливає на обмежену когорту пацієнтів, ще не означає безпроблемну застосовуваність такої терапії до всіх без винятку хворих. Знову-таки: питання до клініцистів, які володіють якісними і кількісними методами оцінки й передбачення ефективності певних методів лікування. А нам – біологам – залишається милуватися красою та складністю природи, і застосовувати увесь арсенал своєї уяви і винахідливості для пошуку відповідей на питання, що вона перед нами ставить.
Даниїл Грибчук для Моєї Науки
Запрошую продовжити читання про можливості використання CRISPR/Cas9 для швидкого моделювання канцерогенних мутацій in vivo на сторінках мого блогу:
Шляхами непокірних клітин | Молекулярно про Рак >>
Посилання
Online Mendelian Inheritance in Man®, entry #601373 (chemokine, cc motif, receptor 5; ccr5)
Cohen J. Building an HIV-Proof Immune System. Science. Vol. 317, No. 5838 (August, 2007): 612-614.
Holmes M.C., JuneC.H.,et al. Establishment of HIV-1 resistance in CD4+ T cells by genome editing using zinc-finger nucleases. Nature Biotechnology. Vol. 26, No. 7 (July, 2008): 808-816.
JuneC.H., Bruce B.L., et al. Gene Editing of CCR5 in Autologous CD4 T Cells of Persons Infected with HIV. The New England Journal of Medicine. Vol. 370, No. 10 (March, 2014): 901-910.
Rossi D.J., Cowan C.A., et al. Efficient Ablation of Genes in Human Hematopoietic Stem and Effector Cells using CRISPR/Cas9. Cell Stem Cell. Vol. 15 (November, 2014): 643–652.





Обговорення