Стовбурові клітини: вихваляти не можна критикувати
11 Листопада 2020 | Ольга Маслова
Категорії: Біологія, Медицина, Щеплення правдою
Теги: біологія розвитку, доказова медицина, кріобіологія, стовбурові клітини, терапія, Щеплення правдою
Часто можна почути запитання «чи працюють стовбурові клітини?» На нього є однозначна відповідь у контексті вашої фізіології: звісно, працюють, і дуже навіть успішно, якщо ви читаєте ці рядки. З тотипотентної стовбурової клітини — зиготи почалось ваше життя, плюрипотентні стовбурові клітини на етапі бластоцисти почали мігрувати та взаємодіяти між собою щоб надалі сформувати зародок і не помилитись у тому, де заплановано створити руку, а де ногу. Мультипотентні клітини далі в кожному із зародкових шарів «чаклували» над побудовою кожної тканини та врешті-решт ви народились. Паралельно із процесами створення вас будувалась та функціонувала інфраструктура для з’єднання організмів матері та дитини. У деяких депо вашого організму й досі залишились запаси мультипотентних клітин для підтримання регенеративних процесів і «швидкої допомоги». Крім того, у багатьох органах присутні менш «різнобічно розвинені» олігопотентні, дипотентні та уніпотентні клітини, що беруть участь у підтримці цілісності тканин та необхідні для «планових заміщень» вже надто втомлених «працівників».
Саме слово «стовбур» обрано невипадково, адже стовбурові клітини здатні до так званого асиметричного поділу. Це означає, що при поділі материнської клітини можуть утворитись не дві абсолютно однакові дочірні, а дві дещо відмінні між собою клітини. Відмінність полягатиме в тому, що одна з нових клітин при потребі піде шляхом диференціювання у певному напрямку (з відповідними наслідками, перетвореннями, часто — подальшими поділами та неминучою смертю через певний час), а інша залишиться повною копією материнської стовбурової та чекатиме нового виклику. Таким чином зберігається умовний стовбур — незмінна кількість стовбурових клітин. На перший погляд здається, що цей запас нескінченний, однак на кількість та «самопочуття» стовбурових клітин, насправді, впливає багато різних факторів, тому їхня кількість може зменшуватись через зміни стану ніші — місця, де мультипотентні клітини себе «почувають максимально комфортно» — та різні шкідливі для організму впливи.
Але ви, певно, зазначите, що у запитанні «чи працюють стовбурові клітини?» мали на увазі не це. Найчастіше це питання стосується стовбурових клітин як «чудодійного засобу» про який майже всі щось чули, але й гадки не мають як це працює (або ні). Отже, оцінки й обговорення ефективності доцільно проводити з точки зору «промислового застосування» клітин як біоматеріалу у ролі терапевтичного агента, а не їхніх біологічних властивостей у «рідному» живому організмі. Але у зв’язку з тим, що типів стовбурових клітин багато, а їхні властивості та перспективи застосування — різні, оцінити «чудодійність» лікарського засобу тільки за згадкою терміну стовбурова клітина — неможливо. Класифікація стовбурових клітин також цікава тема, адже ми маємо дві системи: за ступенем широти перетворення (-потентності) та за локацією чи джерелом отримання. Спрощена схема — нижче:
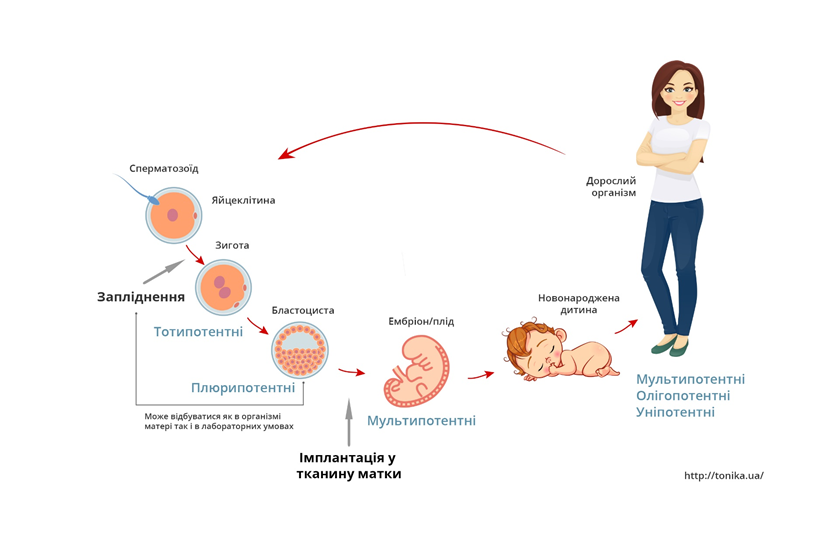
- Ранні (зигота) — тотипотентні
- Ембріональні (бластоциста) — плюрипотентні
- Фетальні (на внутрішньоутробному етапі) — плюри/мультипотентні
- Неонатальні (пуповинна кров, тканина пуповини) — мультипотентні
- Дорослі (кістковий мозок, стромально-васкулярна фракція жирової тканини та багато інших джерел) — мульти/оліго/уніпотентні
- Індуковані (лабораторно перетворені спеціалізовані клітини) — плюрипотентні
Також усередині окремих типів є свої детективні історії про коректність назви. Наприклад, розшифрувати абревіатуру МСК можна як мінімум чотирма способами, або називати той самий тип клітин взагалі зовсім по-іншому.
Одна з головних проблем в обговореннях — змішування трьох основних царин, які зацікавлені у роботі зі стовбуровими клітинами: наука, медицина та бізнес. Чому стовбурові клітини важливі для науки — зрозуміло. Науковці досліджують живе та етапи його розвитку від запліднення до смерті, моделюють у культурі різні стани, словом, як завжди, намагаються зрозуміти як працює та розвивається життя. Медики шукають спосіб позбутися певних захворювань, знайти заміну лікарським засобам, що є недостатньо ефективними і при цьому, звісно, не нашкодити пацієнту. Представникам бізнесу потрібно якось ввести біоматеріал в економічний колообіг та навчитися генерувати прибутки на виробництві певних препаратів із цього біоматеріалу, лікуванні цими препаратами та загалом створенні індустрії, що забезпечуватиме умови роботи із клітинами: отримання матеріалу, лабораторні маніпуляції, у тому числі культивування та кріозберігання, медичні маніпуляції тощо. В ідеальних умовах усі три згадані царини мали б доповнювати одна одну.
Міфи навколо стовбурових клітин в основному з’являються через дві форми крайнощів: очікування «чарівної пігулки», що вилікує усе, та надмірні залякування, що часто зводяться до релігійних чи біоетичних питань, які поставали при роботі з окремими типами клітин і при обговоренні неонатальних чи дорослих клітин не є актуальними.

Отже, кілька ключових тез:
Фундаментальні дослідження стовбурових клітин — беззаперечно необхідні. Тут навіть пояснень не потрібно.
Клінічні дослідження (а їх на сьогодні за даними clinicaltrials.gov майже 8000 — це й колишні, що завершені як з позитивними так і з негативними результатами або взагалі припинені без пояснень, і теперішні, і внесені у реєстр, але ще не розпочаті) не означають масового використання біоматеріалу. Про те, як працює сучасна доказова медицина і як виконуються якісні клінічні дослідження вже написано багато. Єдина проблема у випадку із клітинною терапією — що це все ж не “фарма”, не таблетки, і деякі методологічні підходи до клінічних досліджень і їхньої оцінки тут ускладнюються. Ідеально стандартизувати клітинний матеріал практично неможливо. Аутологічні (застосування своїх клітин) та алогенні (донорські) трансплантації мають свої переваги та недоліки. «Приготування» препарату часто включає лабораторний етап — культивування, яке саме по собі є складним процесом, у який втручається безліч факторів і поки що не існує ідеальної автоматизованої системи для оптимізації цього процесу (хоча щось новеньке з’являється постійно, і ми чекаємо на якийсь прорив). Клінічні дослідження дуже необхідні і для хворих на ті захворювання, що на сьогодні не є повністю виліковними, чи на ті, лікування яких іншими методами є досить небезпечним — це прекрасний шанс отримати експериментальну терапію та, можливо, унікальний шанс на одужання. Під час клінічних досліджень стан пацієнта ретельно оцінюється та вивчаються усі можливі побічні та віддалені ефекти. Також варто зазначити, що від стовбурових клітин в основному очікують два типи ефектів: пряме заміщення якогось типу клітин, або паракринні ефекти «регенеративного менеджменту», які часто важко оцінити.
Але комерційні клініки не можна порівнювати з науковими установами. Найчастіше за гроші пропонується не участь у грамотно спланованому клінічному дослідженні, а недостатньо перевірена методика, після застосування якої ніхто не відслідковуватиме стан пацієнта роками та не перейматиметься віддаленими ефектами.
Клітинні продукти (терапевтичні агенти) це не універсальна “фарма”, тому навряд чи колись ми зможемо просто придбати в аптеці клітинний препарат від усіх хвороб. Використання клітин на всіх етапах від отримання матеріалу до введення продукту пацієнту потребує участі спеціалістів (і це навіть не одна людина, що виконує усі процедури). Будь-яка порція клітинного матеріалу (навіть взята від однієї й тієї ж людини) є унікальною і може врешті мати дещо відмінні ефекти.
Сьогодні вже існують затверджені FDA та ЕМА клітинні продукти, але їхня наявність не означає дозвіл на будь-яку клітинну терапію. Навіть застосування якогось одного типу клітин для лікування певної патології не означає «зелене світло» для застосування того ж типу клітин для лікування іншої хвороби.
Окрім застосування самих клітин все активніше розвивається створення продуктів із кондиційованих середовищ — рідин, у яких культивувались клітини, та окремих пухирців екзосом, що містять важливі регуляторні речовини.
У всьому світі існує велика кількість послуг, пов’язаних із кріозберіганням, тобто низькотемпературним замороженням біоматеріалів, найчастіше — неонатальних. Банки таких матеріалів бувають публічними та приватними. Порівняння — у таблиці. Банки не можна порівнювати з клініками, вони лише зберігають, а не застосовують матеріал. Якщо, звісно, мова не йде про великий медичний комплекс у складі якого є і банк, і клініка, чи про якусь окрему співпрацю. Банки (і публічні, і приватні) також часто підтримують наукову діяльність у відповідних установах.
| Публічне | Приватне |
| Матеріали надаються добровільно й безкоштовно для донора, з відповідним юридичним супроводом | Забирання, обробка та зберігання матеріалів — платні (часто високі ціни) |
| Неякісні чи сумнівні матеріали утилізуються чи йдуть на дослідження (контролюється стерильність, об’єм зразка, кількість клітин) | Інколи справжню якість зразка дізнатись неможливо або недостатньо якісний зразок вмовляють зберігати «про всяк випадок» |
| Акцент на наукових дослідженнях та меті допомогти тим, кому зразок справді потрібен | Акцент на емоціях та спекуляція на майбутньому: «своє», «єдиний шанс», «колись вчені придумають спосіб застосувати/збільшити кількість клітин» тощо |
| Алогенні трансплантації з можливістю обрати оптимального донора та/або зробити комбінований трансплантат з кількох зразків | Аутологічні трансплантації з вкрай низькою вірогідністю застосування або спроба врятувати близького родича |
| Втрачається «ексклюзивність», але у деяких банках є опція позачергового отримання зразка (вже донорського) для тих, хто надав свій матеріал | «Біострахування» і футуризм |
Отже, стовбурові клітини — класні. Перспективи, які вони нам вже відкрили і ще відкривають — вкрай важливі. Співпраця науки, медицини і бізнесу — єдиний конструктивний шлях до впровадження нових ефективних та безпечних терапевтичних агентів у світову практику. Не потрібно створювати собі як ворога так і кумира із цього надзвичайно потужного об’єкта.
Посилання:
- Wyles, S. P., Hayden, R. E., Meyer, F. B., & Terzic, A. (2019). Regenerative medicine curriculum for next-generation physicians. NPJ Regenerative Medicine, 4(1), 1-5.
- Pittenger, M. F., Discher, D. E., Péault, B. M., Phinney, D. G., Hare, J. M., & Caplan, A. I. (2019). Mesenchymal stem cell perspective: cell biology to clinical progress. NPJ Regenerative medicine, 4(1), 1-15.
- https://clinicaltrials.gov/ct2/results?cond=&term=stem+cell&cntry=&state=&city=&dist=
- Aly, R. M. (2020). Current state of stem cell-based therapies: An overview. Stem Cell Investigation, 7.
- Gowen, A., Shahjin, F., Chand, S., Odegaard, K. E., & Yelamanchili, S. V. (2020). Mesenchymal Stem Cell-Derived Extracellular Vesicles: Challenges in Clinical Applications. Frontiers in Cell and Developmental Biology, 8.
- Balistreri, C. R., De Falco, E., Bordin, A., Maslova, O., Koliada, A., & Vaiserman, A. (2020). Stem cell therapy: old challenges and new solutions. Molecular Biology Reports, 1-15.
- https://www.fda.gov/vaccines-blood-biologics/biologics-research-projects/development-strategies-improve-cell-therapy-product-characterization
- https://www.hopkinsallchildrens.org/Patients-Families/Health-Library/HealthDocNew/Cord-Blood-Banking
- ten Ham, R. M., Hövels, A. M., Hoekman, J., Frederix, G. W., Leufkens, H. G., Klungel, O. H., … & Zwaginga, J. J. (2020). What does cell therapy manufacturing cost? A framework and methodology to facilitate academic and other small-scale cell therapy manufacturing costings. Cytotherapy.
- Benabdellah, K., Sánchez‐Hernández, S., Aguilar‐González, A., Maldonado‐Pérez, N., Gutierrez‐Guerrero, A., Cortijo‐Gutierrez, M., … & Martin, F. (2020). Genome‐edited adult stem cells: Next‐generation advanced therapy medicinal products. Stem Cells Translational Medicine, 9(6), 674-685.
- Lloyd‐Williams, H., & Hughes, D. A. (2020). A systematic review of economic evaluations of advanced therapy medicinal products. British Journal of Clinical Pharmacology.
- Harrell, C. R., Jovicic, N., Djonov, V., & Volarevic, V. (2020). Therapeutic Use of Mesenchymal Stem Cell-Derived Exosomes: From Basic Science to Clinics. Pharmaceutics, 12(5), 474.
- Peberdy, L., Young, J., Massey, D., & Kearney, L. (2020). Maternity health professionals’ perspectives of cord clamp timing, cord blood banking and cord blood donation: a qualitative study. BMC pregnancy and childbirth, 20(1), 1-10.
- Murdoch, B., Marcon, A. R., & Caulfield, T. (2020). The law and problematic marketing by private umbilical cord blood banks. BMC Medical Ethics, 21(1), 1-6.
- Allan, D. S. (2020). Using umbilical cord blood for regenerative therapy: Proof or promise?. Stem Cells, 38(5), 590-595.
- Kurtzberg, J. (2020). The view for cord blood is “cup half full” not “cup half empty”. Stem Cells Translational Medicine, 9(10), 1118.
А також виступ авторки на конференції TEDx 2018 року. Наука не стоїть на місці, але основні тези досі актуальні.
Заголовне зображення допису: автор UCSD Jacobs School of Engineering – David Baillot, ліцензія: CC 3.0 – Jacobs School of Engineering, UC San Diego
Цю статтю опубліковано в рамках проєкту “Щеплення правдою”, покликаного просувати цінності критичного мислення та навчати українців відрізняти фейки від надійної інформації в пов’язаних з наукою галузях. Проєкт виконує команда “Моя наука” разом з громадською організацією Unia Scientifica за підтримки Міжнародного Фонду “Відродження”.





Обговорення