Школа выживания в тимусе или Как подготовить идеального киллера
6 Січня 2013 | Оксана Сулаева
Категорія: Біологія
Теги: епітелоретикулярні клітини, лімфоцити, селекція, т-кілери, тимус
Тимус. С чем можно сравнить этот центральный орган кроветворения и иммуногенеза? Разве что с Шаолинем – легендарным центром боевых искусств. Ведь именно здесь формируются Т-киллеры, способные распознавать и убивать клетки, несущие антигенные детерминанты.
Медики привыкли ассоциировать патологию тимуса с гипо-, аплазией или гиперплазией, на худой конец – с кистами и пр. На самом деле нарушение работы тимуса может быть невидимым макроскопически, но ой как ощутимым на уровне организма. Не верите? Извольте, как Вам такие проблемы: возрастное снижение количества Т-лимфоцитов и соответствующее нарушение иммунитета, онкологическая патология, аутоиммунные заболевания и пр.
Будем откровенны – иммунитет во многом зависит от этого небольшого органа, рано подвергающегося инволюции, и такого чувствительного к стрессам. Ведь тимус – это не просто орган кроветворения и иммуногенеза. Это место, где закладываются центральные механизмы толерантности к аутоантигенам (то есть к собственным белкам).
У тех, кто видел, как выглядит лимфоцит, может возникнуть вопрос: что сложного в образовании этой клетки, большую часть которой занимает темное (неактивное) ядро, окруженное узким ободком цитоплазмы? На самом деле за кажущейся простотой Т-клеток скрывается сложнейшая программа развития, жесточайший отбор (селекция), высокий риск гибели и уникальный арсенал молекул, обеспечивающих взаимодействие лимфоцитов не нелимфоидными клетками.
Ведь помимо Т-клеточного рецептора (TCR), обеспечивающего связь с антигеном, Т-лимфоциту нужны еще корецепоры для стыковки с молекулами главного комплекса гистосовместимости (MHC) I и II классов – соответственно CD8 и CD4. Обязательным фактором в рецепторном комплексе активации Т-лимфоцитов является CD3. Добавьте к этому молекулы, необходимые для взаимодействия с эндотелием (в том числе для хоминга), матриксом соединительной ткани и взаимодействия с эпителиоцитами (для миграции) – и получите полный набор отмычек взломщика.
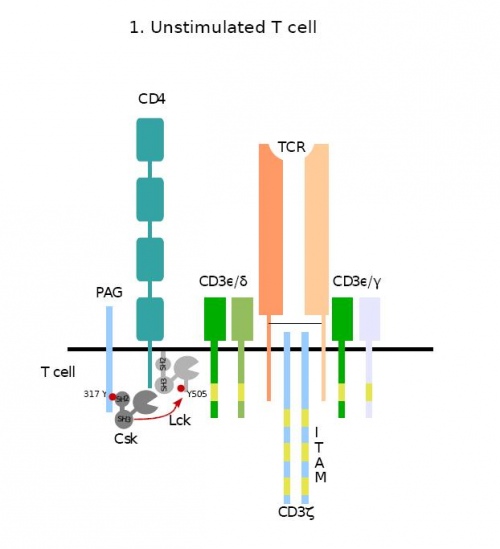 Рис. 1. Рецепторы нестимулированного Т-лимфоцита (в данном случае — Т-хелпера, что подсказывает нам наличие CD4).
Рис. 1. Рецепторы нестимулированного Т-лимфоцита (в данном случае — Т-хелпера, что подсказывает нам наличие CD4).
Но главное для киллера, конечно, убивать чужое для того, чтобы сохранить своё в рамках так называемого поддержания иммунологического гомеостаза. Попытаемся разобраться, как это происходит.
Из анамнеза: или как нянчить киллера?
Как у любого человека есть корни, так и у любой клеточной линии есть свой прогенитор (клетка-предшественник). Источником формирования Т-лимфоцитов является мультипотентная гемопоэтическая клетка-предшественник (в отечественной литературе называемая КОЕ-Лф), которая с током крови попадает из красного костного мозга в тимус.
Естественно, у пытливых умов может возникнуть вопрос: а могут ли Т-лимфоциты образоваться из клеток-предшественниц в другом органе? Нет. Эта уникальная клеточная линия формируется только в тимусе под влиянием клеток микроокружения, которые называются эпителиоретикулоциты (а в версии арубежных авторов – тимические эпителальные клетки). Как выяснилось, эти клетки разнообразны как по морфологии, так и по молекулярной биологии, что связано с зональной гетерогеностью тимуса. сегодня выделяют как минимум 6 типов эпитеоретикулоцитов, среди которых всем известные «клетки-няньки». При этом мы с Вами понимаем, что нянька няньке рознь. Самыми добрыми из них являются эпителиальные клетки наружной части коркового вещества дольки тимуса.
Эти клетки экспрессируют уникальные сигнальные «инструкции» (к примеру, Delta-like Notch лиганды), которые активируют Т-клеточную судьбу через Notch сигнализацию. Notch сигнальная система включает два взаимосвязанных процесса – дифференцировку и коммитирование. На первом этапе происходит превращение клеток-предшественниц (Lin−CD44+c-kit+CD25−) в незрелые тимоциты (Lin−CD25+CD44−). При этом транскрипционный профиль прогениторов ограничивает возможность их превращения в B-лимфоциты, клетки миелоидного ряда, дендритные клетки и натуральные киллеры. Параллельно при активации сигналов Notch происходит включение программы дифференцировки T-клеток. Ключевым ее реализатором является ДНК-связывающий белок – T-cell factor 1 (Tcf-1), который подобно другим T-клеточным факторам (Tcf/Lef), опосредует активацию транскрипции при связи с β-катенином в ответ на сигналы Wnt или транскрипционную репрессию при связи с Groucho. При этом стоит отметить, что Tcf-1 необходимы как на ранних стадиях лимфопоэза в тимусе, так и для антиген-зависимой пролиферации и дифференцировки Т-лимфоцитов в периферических органах (при реализации реакций клеточного иммунитета). Дефект экспрессии Tcf-1 ведет к снижению метаболизма ДНК, экспрессии c-kit и генов, вовлеченных в метаболизм ДНК, модификацией хроматина при усилении апотоза тимоцитов.
Все так сложно! Но, что поделать – это иммунитет, в нем всё не просто.
Нужно оговориться, что даже морфологически долька тимуса устроена совсем нетривиально! Морфологически в каждой дольке выделяют корковое и мозговое вещество.
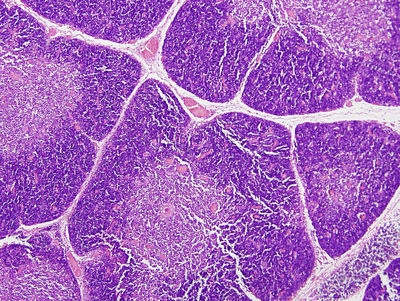 Рис. 2. Тимус. Окраска гематоксилином и эозином. Видны дольки неправильной формы, образованные лимфоидной тканью. Обратите внимание, что в каждой дольке есть темное корковое вещество (на периферии), а центре расположно светлое мозговое вещество. При дифференцировке лимфоциты перемещаются от периферии к центру (в сторону МВ). Внимание вопрос: почему мозговое вещество светлое?
Рис. 2. Тимус. Окраска гематоксилином и эозином. Видны дольки неправильной формы, образованные лимфоидной тканью. Обратите внимание, что в каждой дольке есть темное корковое вещество (на периферии), а центре расположно светлое мозговое вещество. При дифференцировке лимфоциты перемещаются от периферии к центру (в сторону МВ). Внимание вопрос: почему мозговое вещество светлое?
Функционально же все гораздо сложнее. И на основании процессов, происходящих в дольке и молекулярных маркеров созревания тимоцитов, да и эпителоретикулярных клетко в дольке тимуса отечественные гистологи выделяют 4 зоны:
- Наружное корковое вещество – тонкий слой толщиной в 3-4 клетки. Здесь расположены прогениторы и происходит антиген-независимая пролиферация клеток – лимфобластов;
- Глубокая кора – формирует большую часть коркового вещества – здесь происходит дифференцировка тимоцитов, что сопровождается появлением на их поверхности рецепторов к антигенам и маркеров – CD4, CD8;
- Мозговое вещество – зона, куда поступают зрелые лимфоциты, отсюда они попадают в кровь и заселяют Т-зоны периферических органов иммуногенеза;
- Периваскулярная зона – зона вокруг внутридольковых сосудов. В корковом веществе – содержит структуры гемато-тимусного барьера. В мозговом веществе расположены посткапиллярные венулы, через которые происходит выход лимфоцитов в кровь, а также рециркуляция лимфоцито
Зарубежные авторы отдельно рассматривают и кортикомедуллярную границу. И делают они это совсем неслучайно – это рубеж как для обучающихся тимоцитов, так и для из наставников – тимических эпителиальных клеток.
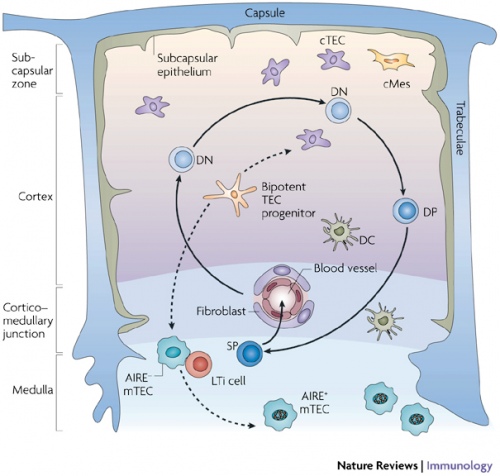 Рис. 3. Зоны дольки тимуса.
Рис. 3. Зоны дольки тимуса.
Зональная гетерогенность определяется не только пространственными характеристиками, но и процессами происходящими в разных регионах дольки тимуса. А процесс во многом – от их исполнителей – тимических эпителиальных клетко (ТЕС) и лимфоцитов, вовлеченных в программу дифференцировки.
Да и сами тимические эпителиальные клетки – ох какие непростые барышни! И все такие разные! Причем если у людей принято, что “человек определяет место”, то у эпителиоретикулоцитов – все наоборот. Судите сами – по их классификации:
Выделяют следующие типы эпителиоретикулоцитов:
- I тип – расположены на границе с перегородками и капсулой, окружают сосуды коркового вещества, формируют барьер;
- II тип находятся внутри коркового вещества и окружают тимоциты. Эти клетки имеют отростчатую форму и карманы, в которых расположены лимфоциты. Регулируют деление и дифференцировку лимфоцитов, поэтому их также называют «клетки-няньки»;
- III тип образуют функциональный барьер между корковым и мозговым веществом. Презентируют тимоцитам антигены собственного организма;
- IV тип находятся в мозговом веществе. Вместе с III типом образуют барьер между корковым и мозговым веществом и участвуют в селекции;
- V тип формируют каркас мозгового вещества;
- VI тип – секреторно активные клетки, образующие эпителиальные слоистые тельца – тельца Гассаля. Секретируют тимозин и тимопоэтин.
Русская рулетка – тимусный вариант
Что ж программа Т-клеточной дифференцировки запущена, пора ставить производство киллеров на поток?! Но не тут-то было: хороший киллер – штучный товар! И право на убийство стоит дорого! В 95-98% случаев претендент в киллеры расплачивается за неудачу собственной жизнью. Цена определяется механизмами образования Т-клеточных рецепторов, чем-то напоминающими русскую рулетку. На всякий случай напомню, что один лимфоцит (своим TCR) может распознавать только одну разновидность антигенов. Поэтому, чем шире будет репертуар TCRs (а значит и разнообразие лимфоцитов), тем более широкой окажется панель иммунологической защиты организма. С одной стороны – широкое поле для фантазии художников. А с друго в самом процессе образования Т-клеточных рецепторов есть как минимум два парадокса:
- Оказывается, что для создания рецептора к антигену, то есть чужому, достаточно хорошенько порыться в собственном геноме (о механизмах сборки и формировании репертуара TCRs Вам лучше всего расскажут эпигенетики)
- КПД процесса образования Т-лимфоцитов составляет 2-5%! То есть только единичные лимфоциты, проходящие процесс антиген-независимой дифференцировки являются качественными, все остальные – брак! и должны подвергнуться «зачистке» с запуском программ принудительного самоуничтожения (апоптоза)!
Почему? Да они создают рецепторы к собственным антигенам! И если такие лимфоциты попадут в системный кровоток – они с маниакальной методичностью будут уничтожать собственные структуры!
И вот тут стоит отдать должное “порядочности” наших лимфоцитов: в отличие от многих выпускников отечественных медицинских вузов, у Т-лимфоцитов существует неписаный кодекс чести – как бусидо японских самураев. Если лимфоцит некомпетентен и не умеет отличать свое от чужого – он погибает, выполняя древний обряд харакири (в смысле, апоптоза).
Отсюда вывод – с геномом (и его реаранжировкой) шутить опасно! И уж если вы решили сыграть с ним в рулетку – будьте готовы к …. или включите хотя бы такие же механизмы контроля, которые работают в тимусе.
Последние предполагают негативную и позитивную селекцию Т-лимфоцитов. Вот здесь-то и зарыт ключ толерантности к собственным белкам-антигенам. Занимаются этой селекцией эпителоретикулоциты глубокой коры и мозгового вещества дольки тимуса, а также профессиональные АПК (дендритные клетки). Но и здесь есть свои загадки и тайны, неразрешимые на первый взгляд. Первая загадка заключается в том, что фактор толерантности к аутоантигенам связан с формированием CD4+ (маркера хелперов) и Вы вправе возмутиться: «ведь убивают-то киллеры (CD8+)». Вторая тайна еще более грустная: клетки, которые нянчили и выхаживали Т-лимфоциты в ходе их дифференцировки берут на себя роль провокаторов, представляя доверчивым «ученикам» ….. собственные антигены, чтобы потом безжалостно обречь их на харакири!
На самом деле все просто: в процессе дифференцировки, помимо TCRs и CD3, Т-лимфоцитов экспрессируют на своей поверхности одновременно CD4CD8, что позволяет им свободно стыковаться как с МНС I, так и с МНС II класса. И только после негативной селекции включается механизм сортировки на CD4+ и CD8+ субпопуляции. И с эпителиоретикулоцитами все просто – контроль качества без излишней эмпатии, ведь «мы в ответе за тех, кого мы приручили или не научили».
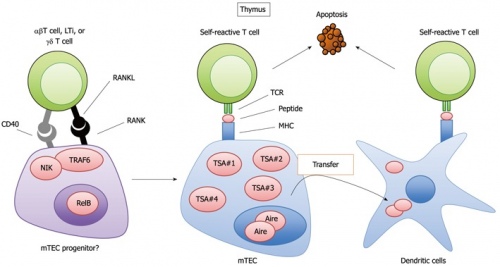 Рис. 4. Механизмы негативной селекции Т-лимфоцитов.
Рис. 4. Механизмы негативной селекции Т-лимфоцитов.
Медуллярные тимические эпителиальные клетки (mTEC) представляют лимфоцитам тканеспецифические антигены (TSA). И если те их распознают (демонcтрируя наличие TCR), то милые добрые нянюшки сообщают об этом экзекуторам – дендритным клеткам, которые при пересмотре дела выносят приговор “казнить нельзя помиловать”. Запятую при этом ставят по-разному, поэтому не перевелись еще аутоиммуные заболевания в роду человеческом (а что поделать, никто не застрахован от ошибок). В спровоцированном Т-лимфоците через CD95 аквтивируется запуск программы апоптоза, поэтому в мозговом веществе мы видим только элиту Т-лимфоцитарной линии – выпускников, прошедших самый жесткий отбор, умеющих узнавать и убивать антиген, но безопасных для хозяина (по сути – самураи).
Теперь мы с Вами понимаем, какая ответственность лежит на эпителоретикулоцитах тимуса. Именно от них зависит качество нашего иммунитета (и как не провести аналогию с преподавателями медицинских университетов, от качества работы которых зависит количество потенциальных убийц в практической медицине)! А отчего зависит профессиональная зрелость самих эпителоретикулоцитов? Как выяснилось, созревание медуллярных эпителиоретикулов, экспрессирующих аутоиммунный регулятор (Aire) и широкий спектр тканеспецифических антигенов (TSA), зависит от активации of NF-κB через RANK и его лиганд (RANKL – кстати, на поверхности Т-клеток). Цитоплазматический регион RANK содержит связывающие сайты для факторов, ассоциированных с рецепторами к фактору некроза опухолей (TRAF) – TRAF2, 3, 5. Последние активируют NF-κB и MAPK-каскад, что приводит к транскрипционной активации генов, необходимых для пролиферации, выживания и дифференцировки.
Ну и напоследок, как обойтись без контрольного выстрела на добивание мозга после нового года вопросом: а киллера-то как получить из CD4+CD8+ предшественника?! Оказывается дифференцировка двойного позитивного лимфоцита CD4+CD8+ в специалиста CD8+ регулируется TCR и сигналами с рецепторов к цитокинам. Среди последних ведущую роль играет ИЛ-7, задействованный в механизмы позитивной селекции, и опять с участием β-катенина. Именно его экспрессия усиливает сигнал с рецептора к ИЛ-7 во время позитивной селекции, что промотирует развитие CD8 лимфоцитов.
PS: А в тимусе-то даже после инволюции происходит рециркуляция лимфоцитов. Знаете зачем?
Рекомендуемые ссылки
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3128475/
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2742656/
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3502610/
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3492225/
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2855701/





Обговорення