Дисперсні системи
У школі усіх навчають, що у природі речовина може бути в одному із чотирьох агрегатних станів: твердому, рідкому, газоподібному та плазменному. Однак досить часто ми стикаємося із ситуаціями, коли агрегатний стан певної речовини ми визначити просто не можемо. Саме так і відбувається із хмарами, зубною пастою, глиною. Описати стан усіх цих речей можно словом «дисперсна система».

Те, що здається нам якимось особливим станом речовини, насправді є їх поєднанням особливим чином. Однак для того, щоб зрозуміти, що ж таке є дисперсна система, треба почати із такої досить незвичної штуки, як термодинамічна фаза. Термодинамічна фаза — це певна кількість речовини, однорідна у хімічному та фізичному плані і відділена від іншої речовини поверхнею поділу фаз. Останнє уточнення здається дещо штучним, однак воно дуже важливе, оскільки саме на поверхні поділу фаз відбувається купа не дуже зрозумілих на перший погляд, але досить важливих для нас явищ.
Так от, дисперсна система — це така система, яка складається із двох чи більше термодинамічних фаз, причому одна фаза міститься всередині іншої. Та, що знаходиться всередині зветься дисперсною фазою, а та, яка її оточує — це дисперсійне середовище. При цьому ці дві фази не змішуються, але і не розділяються повністю. Якщо це відбувається ( наприклад якщо дисперсна фаза випадає у осад) то системаруйнується.
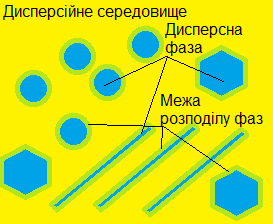
При цьому треба зазначити, що і дисперсна фаза і дисперсійне середовище можуть знаходитися у будь-якому із трьох агрегатних станів (плазма у вільному стані на Землі зазвичай не зустрічається) і в залежності від цього дисперсійні системи можуть виглядати геть по-різному. Єдине, що не утворює дисперсійну систему — це газ із газом, бо молекули газів увесь час рухаються і легко перемішуються, тому поверхня розділу фаз між ними не утворюється. Ви могли б заперечити, що пара, яку ми бачимо над чашкою гарячої кави — це і є приклад такої системи, однак там у якості дисперсної фази виступає не газоподібний стан усім відомого оксиду водню, а його дрібні крапельки, що встигають конденсуватися у повітрі безпосередньо після того, як вода випаровується.
Системи, у яких дисперсійним середовищем є газ, а дисперсна фаза — рідка чи тверда називаються аерозолями. Зазвичай ми звикли до того, що аерозолі — це щось, що продається у балончиках та випускається у повітря за нашим бажанням. Насправді ж аерозолями є багато інших речей, починаючи від диму і туману і закінчуючи хмарами у небі. Тому аерозолі — це мабуть ті дисперсні системи, які відомі геть усім.

Однак дисперсні системи, у яких дисперсійним середовищем виступає рідина не менш важливі для нас. Бо сама наша кров є такою системою і дуже важливим є її підтримання у стані саме дисперсної системи. Взагалі дисперсні системи із рідким середовищем поділяються на три типи в залежності від того, у якому стані у них знаходиться дисперсна фаза. Суспензії, у яких дисперсна фаза є твердою є найрізноманітнішими. Сюди входять і людська кров, і томатна паста і мул у воді.
Що стосується емульсій, то це мабуть найнезвичайніший вид дисперсних систем, оскільки саме тут далеко не всі речовини можуть виступати у якості дисперсної фази. Для більшості речовин спроба отримати дисперсну систему типу “рідина у рідині” закінчується приблизно так само, як спроба отримати дисперсну систему із двох газів. Однак із речовин, які зазвичай вільно змішуються між собою все ж створюють емульсії. Для цього застосовують додаткові речовини, які називаються емульгаторами. Зазвичай це якісь рідини, молекули яких мають полярну структуру і створюють захисну плівку навколо часток тієї рідини, що має виступати у якості дисперсної фази. Такий прийом зокрема дуже часто використовується у харчовій промисловості, коли треба замінити речовину, яка у певному середовищі утворює дисперсну систему природнім чином дуже схожою на неї, але такою, що зазвичай у даних умовах не диспергує.

Окремо слід сказати про випадок коли дисперсну систему із рідиною утворює газ. На перший погляд це виглядає досить екзотично, але насправді із подібними системами ми також зустрічаємося ледь не щодня. Бо найпоширенішим представником газових емульсій є усім нам звичні піни: піна для гоління, піна на пиві, монтажна піна. Утворюються піни тоді, коли газу у рідині більше, ніж його у ній може розчинитися. Чому такий газ просто не виходить із неї, як це зазвичай буває? Причиною є сила поверхневого натягу, яка саме і виникає на границі розподілу фаз. Сила ця може бути настільки великою, що вона врівноважує силу Архімеда і рідина просто не може виштовхнути із себе газ. Звичайно, що це переважно можливе у тих випадках, коли площа поверхні бульбашки достатньо велика у порівнянні із її об’ємом. Тож зазвичай такий фокус виходить тільки із невеликимибульбашками. До речи, умови рівноваги в усіх попередніх дисперсних системах також багато у чому визначаються саме силою поверхневого натягу. Наприклад форму хмар також багато в чому визначає саме вона.
Що ж стосується дисперсних систем із твердим дисперсійним середовищем, то їхньою цікавою особливістю є те, що у них у порівнянні із попередніми видами сила поверхневого натягу тут не грає такої великої ролі. Натомість дисперсна фаза може відносно легко змінюватися без руйнування структури матеріалу. Почати тут краще із ситуації, коли дисперсна фаза газоподібна. Це будь-яке пористе тіло. Прикладами тут можуть бути і пінопласт і губка у ванній кімнаті. Якщо останню намочити, то вона переходить із стану дисперсної системи із газоподібною дисперсною фазою до системи із рідкою фазою. А якщо таку губку просочити якоюсь речовиною, що може тверднути, то кінцевим результатом стане утворення системи типу “тверде тіло-тверде тіло” яку зазвичай називають композитним матеріалом.

Таким чином ми весь час у своєму житті зустрічаємося із дисперсними системами та їхніми незвичними властивостями, але зазвичай цього просто не усвідомлюємо. І якщо зрозуміти що собою являють такі системи, то багато того, що ми кожен день використовуємо не розуміючи стане більш зрозумілим, але від того не менш цікавим.





Обговорення